Budowa elektronowa cząsteczki tlenu
Jest to krótka notka na temat budowy elektronowej tlenu, która ma za zadanie wyjaśnić, że naprawdę cząsteczka tlenu w stanie podstawowym nie wygląda tak, jak prezentuje to Ryc. 1.
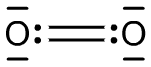
Ryc. 1. Singletowa cząsteczka tlenu
Taki wzór przyjęło się tworzyć na potrzeby szkolne, jednak nie oddaje on elektronowej struktury cząsteczki O2. Aby sprawdzić, jak wygląda rzeczywista struktura elektronowa cząsteczki tlenu należy odwołać się do energetycznego zestawienia MO (orbitali molekularnych).
Jak takie wykresy tworzymy - można znaleźć w tomie Chemia kwantowa. Dla cząsteczki tlenu można zastosować następujący szablon (Ryc. 2.).
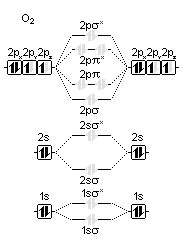
Ryc. 2. Szablon wykresu energetycznego MO dla O2
Następnie zgodnie z zakazem Pauliego i regułą Hunda należy wypełnić rozrysowane MO. Na pierwszej powłoce zostają obsadzone oba utworzone orbitale: 1σ i 1σ*. Na drugiej orbitale atomowe 2s również utworzą dwa zapełnione orbitale molekularne: 2σ i 2σ*. Następnie nakładają się orbitale 2p tworząc dwa orbitale czołowe: 2σ i 2σ* oraz 4 orbitale boczne. W tym dwa wiążące i dwa antywiążące orbitale molekularne 2π. Wszystkie są widoczne na Ryc. 2.
Jednak nie ma już tyle elektronów, aby zapełnić wszystkie utworzone orbitale, tak więc wypełniane są one poczynając od orbitali najmniej energetycznych. Kolejno zapełniane są więc orbital 2σ, oraz dwa orbitale 2π. Następne w kolejce są równoenergetyczne orbitale 2π*. Do rozdysponowania są także dwa elektrony. Zgodnie z regułą Hunda każdy z orbitali 2π* zostanie obsadzony przez jeden elektron. Orbital 2σ* pozostaje nieobsadzony.
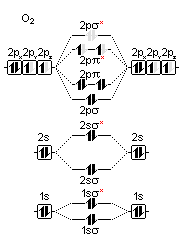
Ryc. 3. Obsadzenie MO w trypletowej cząsteczce O2
Teraz, na podstawie tego wykresu można narysować wzór elektronowy. Elektrony zrębu (1s) pomijamy. Elektrony walencyjne mieszczą się na orbitalach 2s oraz 2p. Wśród nich widać 5 par elektronowych oraz 2 niesparowane elektrony. 4 pary zostały utworzone z już istniejących par na orbitalach atomowych, a jedna z niesparowanych elektronów obu atomów. Tą parę należy uznać za wiązanie (orbital 2σ). Rozdzielając teraz elektrony po równo: każdy z atomów ma po dwie pary elektronowe, jeden elektron sparowany z elektronem drugiego atomu oraz jeden całkowicie niesparowany elektron. Taką sytuację odzwierciedla wzór na Ryc. 4.
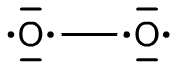
Ryc. 4. Trypletowa cząsteczka tlenu
Cząsteczkę w stanie podstawowym nazwiemy więc trypletową, a stan wzbudzony (Ryc. 1.) to cząsteczka singletowa. Jedna i druga istnieje, z tym, że singletowa jest nietrwała i przechodzi w trypletową, czemu towarzyszy wydzielanie kwantu światła (hν). Wiąże się z tym procesem ciekawe doświadczenie: Świecenie tlenu singletowego.
Cząsteczka O=O ma całkowity spin równy zero, zaś ze względu na niesparowane elektrony cząsteczka •O−O• ma spin równy dwa (stąd właściwości paramagnetyczne tlenu). Tym samym cząsteczkę tlenu możemy uznać za dirodnik (dwa niesparowane elektrony), co wyjaśnia z kolei jej dużą reaktywność w porównaniu z prawie całkowicie bierną cząsteczką azotu N≡N.






