Stopnie utlenienia
Piszę ten tekst ze względu na multum nieścisłości, jakie pojawiają się na temat stopni utlenienia. W dalszej części tekstu postaram się wyjaśnić:
- Co to są stopnie utlenienia?
- Jak nieprawidłowo wyznaczać stopnie utlenienia?
- Jak prawidłowo wyznaczać stopnie utlenienia?
- Czy stopnie utlenienia są potrzebne?
Co to są stopnie utlenienia?
Zacznijmy od definicji:
Stopień utlenienia atomu jest co do wartości równy ładunkowi jonu, który istniałby gdyby wszystkie tworzone z nim wiązania zostały zerwane.
Innymi słowy wszystkie wiązania w takim związku należy uważać za jonowe i wyznaczyć ładunek tego jonu, którego atomu stopień utlenienia nas interesuje.
Jak nieprawidłowo wyznaczać stopnie utlenienia?
Człowiek ma tendencję do upraszczania wszystkiego, jak tylko jest to możliwe. Niestety czasami odnosi to nieciekawe skutki. Dobrym przykładem tego są stopnie utlenienia właśnie. W praktyce często zapominamy o tym, że każdy atom może mieć inny stopień utlenienia i praktycznie nigdy nie wyznaczamy tych stopni w sposób, o jakim mówi definicja. Zazwyczaj (czytaj zawsze) chemicy odwołują się do tzw. uproszczonych zasad wyznaczania stopni utlenienia, które są zbytnio okrojonym przepisem kucharskim na to jak wyznaczyć (nie) prawidłowo stopnie utlenienia. Oto one:
- Stopień utlenienia pierwiastka w stanie wolnym równy jest zero.
- Stopień utlenienia pierwiastka w postaci jonu prostego równa się jego elektrowartościowości (wartościowości jonu).
- Suma stopni utlenienia wszystkich atomów wchodzących w skład jonu złożonego równa jest ładunkowi jonu.
- Suma stopnia utleniania wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero.
- Fluor we wszystkich swych połączeniach występuje na −1 stopniu utlenienia.
- Tlen w połączeniach ma stopień utlenienia −2. Wyjątki stanowią: fluorek tlenu OF2, w którym tlen ma stopień utlenienia +2, ponadtlenki np. KO2, w których stopień utlenienia tlenu wynosi −½ i nadtlenki np. H2O2, Na2O2, BaO2, w których wynosi −1.
- Wodór przyjmuje w swych związkach stopień utleniania równy +1, z wyjątkiem wodorków litowców i berylowców, gdzie stopień utlenienia wynosi −1.
- Stopień utlenienia litowców równy jest +1, a berylowców +2, (metale przyjmują dodatnie stopnie utlenienia).
Od razu zdradzę, że wybrałem taki przepis, w któremu będę wytykał najwięcej wad (to znaczy, że są lepsze). Pomimo, że instruuję jak prawidłowo wyznaczać i używać stopni utlenienia, to wcale nie namawiam do ich używania. Są one zbędne i do rezygnacji z ich używania namawia ten artykuł.
Zacznę od najbardziej (mnie) bulwersującej informacji, że stopień utlenienia tlenu w ponadtlenkach wynosi −½. Jak to możliwe, aby jakikolwiek jon posiadał ładunek −½? Definicja wymaga istnienia takiego jonu (lub przynajmniej quasi-jonu → dalej), aby mógł istnieć taki stopień utlenienia. Wielu osobom z pewnością da to wiele do myślenia i stwierdzą, że jest to jakaś bzdura. Owszem! Spróbujmy się zastanowić skąd się wziął owy tajemniczy stopień utlenienia −½.
Jak mówi punkt 6 stopień utlenienia −½ posiada tlen w ponadtlenkach. Ponadtlenki są to związki zawierające rodnikoanion O2•−. Jego struktura przedstawia się następująco:
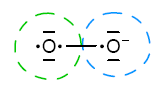
Wynika stąd, że atom, który w tym zapisie znajduje się po lewej jest na stopniu utlenienia 0, a drugi (oznaczony na niebiesko) atom jest na stopniu utlenienia −1. Łatwo teraz dostrzec, że −½ jest średnim stopniem utlenienia obu atomów. Takie podejście do sprawy jest nielogiczne i (wg mnie) błędne.
Stopnie utleniania są wartościami fikcyjnymi więc nie można im przypisywać żadnego fizycznego znaczenia czy próbować na ich podstawie przewidywać czegokolwiek choć są one sposobem na wyznaczanie współczynników stechiometrycznych. Ale tu należy podkreślić, że są tylko (zbędnym) narzędziem do przeprowadzenia bilansu równania.
Spójrzmy teraz na punkty 1, 2, 3 i 4. Jak dla mnie wszystkie mówią o tym samym i wystarczyłby punkt 3. Reszta wynika z niego. Nie będę tłumaczył dlaczego, bo to chyba oczywiste, że jeśli cząsteczka jest obojętna to ma ładunek 0 (etc.). Jednak wszystkie punkty mówią prawdę, która wynika z definicji.
Punkt 5 także nie wymaga zapamiętania ponieważ fluor jest najbardziej elektroujemnym pierwiastkiem i zawsze zabiera elektrony czyli tworzy quasi-jony ujemne. Mianem quasi-jony (pseudo-jony) określam te jony, o których mówi definicja, a które nie koniecznie istnieć muszą, aczkolwiek mogą.
Wróćmy teraz do punktu 6. Pierwsze stwierdzenie wynika z tego, że tlen ma zaraz po fluorze najwyższą elektroujemność. Dlatego tylko z fluorem tworzy związek, gdzie występuje na +2 stopniu utlenienia. O ponadtlenkach już mówiliśmy. Teraz zostały nieszczęsne nadtlenki. Są to związki z grupą O22−. Oto wzór elektronowy:
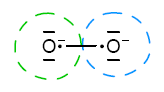
Jak wynika to z powyższego rysunku pomiędzy atomami tlenu występuje wiązanie kowalencyjne, nie powoduje ono zmiany stopnia utlenienia (atomy o równej elektroujemności). Znaki − wskazują na występowanie pojedynczego ładunku ujemnego, dlatego stopnie utlenienia wynoszą −1. Taka sama sytuacja zachodzi w analogicznych jonach, jak np. S22− albo związku H−C≡C−H, gdzie występuje quasi-anion C22−.
Punkt 7 jest zabawny. Wodór występuje na +1 stopniu utlenienia w połączeniu z atomami o χ > 2,1. Symbolem χ (greckie chi) przyjęło się oznaczać elektroujemność. Zaś wodór na −1 stopniu utlenienia znajdziemy w jego połączeniach ze wszystkimi atomami o χ < 2,1. Są to nie tylko litowce i berylowce, ale także (prawie) wszystkie metale i półmetale. Ważna jest tylko elektroujemność!
Punkt 8 mówi, że stopień utlenienia litowców równy jest +1, a berylowców +2, a czemu nie mówi, że stopień utlenienia glinowców wynosi +3? Natomiast prawdą jest, że metale przyjmują dodatnie stopnie utlenienia. Chociaż zastanawiają tu takie związki jak fosforek złota(I) - Au3P gdzie z elektroujemności wynika, że złoto znajduje się na −1, a fosfor na +3 stopniu utlenienia. Ale to tylko teoria. Tak samo możnaby zastanawiać się nad stopniami utlenienia w ksenianie sodu Na4XeO6 (SMILES: [Xe](O[Na])(O[Na])(O[Na])(O[Na])(=O)=O).
Jak prawidłowo wyznaczać stopnie utlenienia?
Teraz dość już narzekania zajmijmy się istotnym problemem odnośnie tego, jak prawidłowo wyznaczać stopnie utlenienia. Jak wiemy od biedy można stosować reguły przytoczone w pierwszym paragrafie, ale wiemy też, że tylko od biedy. Metoda ta uniemożliwia wyznaczanie stopni utlenienia w bardziej skomplikowanych związkach nieorganicznych nie mówiąc już o tych organicznych.
Jedynym stuprocentowo pewnym sposobem na wyznaczanie stopni utlenienia jest taki, o którym mówi definicja. Schemat postępowania może być różny, ale ja przedstawię taki dla początkujących (później sam już dojdziesz do tego jak go uprościć, o ile będzie Ci to potrzebne).
Na początek trzeba narysować wzór elektronowy związku, w którym stopnie utlenienia będziemy wyznaczać. Może to być zarówno dash-dot diagram jak i zwykły wzór Lewisa (dot diagram). Jednakże znacznie łatwiej w tym przypadku pracuje się na wzorze Lewisa. O wzorach znajdziesz w rozdziale Wzory. Związkami, które posłużą do omówienia zagadnienia będą kwas siarkowy(VI) H2SO4 i aceton CH3−CO−CH3. Wzory elektronowe obu związków prezentują się następująco:
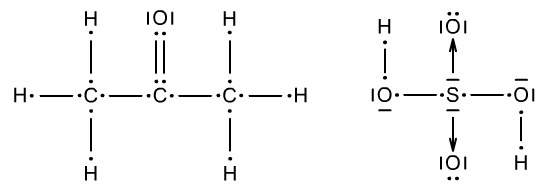
Kolejnym zadaniem jest odnalezienie najbardziej elektroujemnego pierwiastka. Nie jest to wielki problem jeżeli posiadasz UOP. Elektroujemność zmienia się po skosie (najbardziej elektroujemne pierwiastki w górnym prawym rogu, najmniej elektroujemne w dolnym lewym rogu → Elektroujemność i elektrododatniość). Atom bądź atomy o najwyższej elektroujemności zabierają wszystkie elektrony, które mogą (swoje i te, które wchodzą w skład wiązań z danym atomem). Te wszystkie elektrony wraz z atomem, który je zabiera otaczamy owalem. Jeżeli występuje wiązanie pomiędzy dwoma atomami tego samego pierwiastka - należy jeden elektron przydzielić do jednego atomu, a drugi do drugiego. Analogicznie z wiązaniami wielokrotnymi i koordynacyjnymi. Następnie odszukujemy kolejny najbardziej elektroujemny atom pierwiastka (pomijając już zakreślony). Tak samo jak poprzednio otaczamy go i jego elektrony oraz te które zabiera. Nie wolno jednak ruszać elektronów już zakreślonych. Procesy postępowania ukazują Ryc. 4 i Ryc. 5.
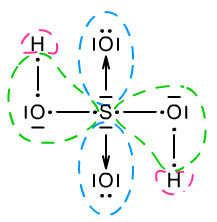
Ryc. 4. Wyznaczanie stopni utlenienia w kwasie siarkowym(VI) H2SO4
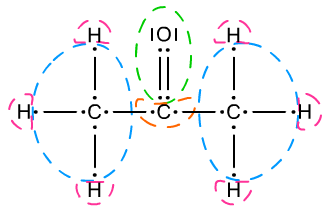
Ryc. 5. Wyznaczanie stopni utlenienia w acetonie CH3−CO−CH3
Ostatni krok to rachunek elektronów. Przy każdym atomie zapisujemy ile ma elektronów walencyjnych. Po prawej stronie od tej liczby zapisujemy ilość elektronów otoczonych owalem, w którym znajduje się ten atom. Wykonujemy odejmowanie i wynik zapisujemy. Np. jeśli siarka ma normalnie 6 elektronów walencyjnych, a w owalu otaczającym atom siarki jest 0 elektronów to z rachunku elektronów wynika, że 6 − 0 = 6. Otrzymana wartość to stopień utlenienia danego atomu. Jeśli nie popełniliśmy błędu we wzorze i rachunkach to wyznaczone stopnie utlenienia są z pewnością dobre.
Jeszcze jedna uwaga. Jeśli mamy do czynienia z jonem, to należy brać pod uwagę ilość elektronów walencyjnych którą ma atom w stanie wolnym, a nie na początku naszych rachunków, co w przypadku cząsteczek obojętnych nie ma znaczenia. Proces wyznaczania stopni utlenienia w jonie ilustruje Ryc. 1.
Czy stopnie utlenienia są potrzebne?
Wbrew temu, co mogłoby się wydawać stopnie utlenienia są praktycznie zbędne. Są jednak często stosowane podobno w celu ułatwienia (czego?). Okazuje się, że można bilansować elektrony w reakcjach redoks bez wyznaczania stopni utlenienia. Stosuje się w tym celu równania połówkowe i postępuje wg wskazówek zawartych na tej stronie Tomasza Plucińskiego, o której mówiłem. Tam znajdziesz kolejne argumenty, które skłaniają do zarzucenia używania stopni utlenienia.
Życie często wymusza jednak od nas stosowanie stopni utlenienia. Np. w szkole, ponieważ nauczyciele są do nich przyzwyczajeni i odpowiedź: "nie umiem używać stopni utlenienia, bo są niepotrzebne" może zaowocować dość niską oceną w dzienniku. Wiem, że nie uczymy się dla stopni, ale jeśli ktoś ma ambicję na ocenę db czy wyższą, to chyba wypada opanować omawiane treści.






