Serie spektralne
Ten temat przyda się przy omawianiu niektórych zagadnień z chemii kwantowej. Jako pomoc w zrozumieniu tego tematu może pomóc Ci program zamieszczony tutaj (Model atomu Bohra z innymi programami przydatnymi później).
Nie będziemy dokładnie mówić o tym, co to są serie spektralne, lecz skupimy się bardziej na tym, jak one powstają.
Historia
Już od dawna zastanawiano się dlaczego sól kuchenna (NaCl) wprowadzona do płomienia palnika powoduje zmianę barwy płomienia na żółty. Dopiero gdy w 1855 roku Robert Bunsen skonstruował nowy rodzaj palnika (tzw. palnik Bunsena), umożliwił on otrzymanie wysokich temperatur i analizę zmiany kolorów płomienia przez wiele innych związków. Płomień palnika Bunsena nie posiadał żadnej intensywnej barwy (bladoniebieski). Od tego czasu badanie substancji za pomocą płomienia palnika stało się uznaną metodą analityczną (służącą do rozpoznawania substancji). Do 1913 zbadano dość dokładnie widma emisyjne i adsorpcyjne znanych pierwiastków. Nie wyjaśniono jednak przyczyn powstawania barw. Niedociągnięcie to zostało nadrobione.
Zjawisko Zeemana
Ogólnie rzecz biorąc widmo to obraz powstały na ekranie na skutek rozszczepienia pewnej wiązki światła w pryzmacie. Wyróżniamy dwa typy widm - adsorpcyjne i emisyjne. Różnica polega na tym, że w wypadku widma emisyjnego rozszczepiamy wiązkę światła wysłanego przez atomy dlatego pierwiastka na skutek wzbudzenia (np. za pomocą prądu elektrycznego lub ciepła), zaś w wypadku widma adsorpcyjnego - rzucamy wiązkę światła białego na próbkę i rozszczepiamy światło, które przez nią przechodzi. Badając widmo emisyjne wodoru stwierdzono, że składa się ono z tzw. serii, a one z poszczególnych linii spektralnych. Występowanie takich prążków w rozszczepionym widmie nazywamy zjawiskiem Zeemana. Jako pierwszy opisu zależności pomiędzy liniami spektralnymi w seriach dokonał Rydberg [raɪdbəg]. Jest on autorem tzw. równania Rydberga, którego postać przedstawia się następująco:
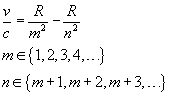
Gdzie (v /c) to liczba falowa linii. Dla różnych wartości zmiennej m wyróżniamy różne serie, i tak:
m = 1 - seria Lymana
m = 2 - seria Balmera
m = 3 - seria Paschena
m = 4 - seria Bracketta
m = 5 - seria Pfunda
m = 6 ...
Przyczyny
Teraz przyszła pora na wyjaśnienie, skąd się to wszystko bierze. To, o czym powiemy zostało ogłoszone przez duńskiego uczonego Nielsa Bohra.
Po pierwsze stwierdził on, że w widmie pojawiają się prążki, (a nie rozmyte plamy) i z tego powodu energie elektronów w atomie nie mogą być dowolne. Bohr przyjął, że elektrony krążą po orbitach nie tracąc przy tym energii (co jest pewnym krokiem w kierunku chemii kwantowej), nie wysyłają też żadnego promieniowania podczas ruchu po orbitach. Stwierdził, że elektrony mogą krążyć tylko w określonych odległościach od jądra. Odległości te wyznaczały orbity i zostały nazwane stanami dozwolonymi. Dla zainteresowanych równanie opisujące energie stanów dozwolonych:
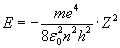
Promienie kolejnych orbit można wyliczyć z równania:
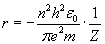
Same prążki w widmie emisyjnym powstają, gdy elektronowi zostanie dostarczony odpowiedni kwant energii (zgodny z równaniem na Ryc. 2) i elektron ten przeskoczy z orbity o niższej energii (o mniejszym promieniu zgodnym z równaniem na Ryc. 3) zwanej stacjonarną na orbitę wyższą o promieniu zgodnym także z tym równaniem. Stan taki nazywamy stanem wzbudzonym. Stan wzbudzenia trwa bardzo krótko i elektron prawie natychmiast wraca na swoją dotychczasową pozycję emitując kwant energii (fala o odpowiedniej długości - jej energia to różnica energii na danych poziomach energetycznych hν = Ew − Es). Położenie prążka w widmie zależy więc od tego jaki kwant światła zostanie wyemitowany. Wynika to z tego, po między którymi orbitami następuje przeskok.
Powrót elektronów z innych powłok (2, 3, 4, 5, 6, 7) na powłokę pierwszą wiąże się z emisją światła o długości fali należącej do nadfioletu. Powrót na powłokę drugą daje światło w zakresie widzialnym, a na powłoki wyższe - podczerwień. Powroty elektronów na powłokę drugą były poznane najszybciej, ponieważ emitowały światło w zakresie widzialnym:
Z 3 na 2 - światło czerwone
Z 4 na 2 - światło zielone
Z 5 na 2 - światło niebieskie
Z 6, 7 etc. - światło fioletowe
Widmo emisyjne wodoru
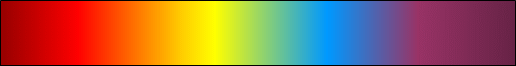
Ryc. 4. Widmo światła białego

Ryc. 5. Widmo emisyjne wodoru
Patrząc na widmo światła białego (Ryc. 4) można zauważyć, że odległości pomiędzy wymienionymi kolorami stale się zmniejszają, a to dlatego, że zmniejszają się różnice energii pomiędzy kolejnymi orbitami, czego można także dowieść z równań na Ryc. 2 i Ryc. 3. Wzory przydatne przy wyliczaniu długości fal i ich energii są następujące:
E = mc2 = hν
ν = c/λ
E - energia
m - masa
h - stała Plancka
c - prędkość światła w próżni
ν - częstość promieniowania (ni)
λ - długość fali (lambda)
Podaję tylko podstawowe wzory, myślę, że z resztą (przekształcanie) sobie poradzisz. Nie jest to może nazbyt jasne, ponieważ są to rozważania teoretyczne. Nie widzimy przecież tych przeskakujących elektronów, ale... pisałem na początku, że jest program, który potrafi obrazować te przeskoki. Można go ściągnąć z działu download (szczegóły na początku paragrafu).






