Wstęp
Chemia kwantowa to jak możnaby kolokwialnie rzec nowa jakość w chemii. Chemią kwantową samą w sobie zajmować się nie będziemy. Darujemy sobie praktycznie całą matematykę związaną z równaniem Schrödingera i funkcjami falowymi. Celem tego działu jest pokazanie tego, do czego chemia kwantowa może przydać się także Tobie. Przybliżymy tu podstawowe pojęcia, które pomogą Ci zrozumieć wiele zjawisk, których do tej pory nie wyjaśnialiśmy.
Chemia kwantowa jest działem chemii, który spogląda na elektron w nieco odmienny sposób. Dotychczas ruch elektronu był opisywany zgodnie z zasadami mechaniki klasycznej. Przypomina się tu model Bohra atomu wodoru (krążąca po orbicie kulka przyciągana do jądra jak Ziemia do Słońca). W chemii kwantowej opisu dokonuje się za pomocą mechaniki kwantowej zwanej również mechaniką falową.
Mechanika falowa
Ab ovo będzie potrzebne wprowadzenie na temat tego, co to jest mechanika falowa i czym ona się w ogóle różni od dotychczas omawianych zagadnień. Różnica jest dość znacząca.
Musimy się przyzwyczaić, że świata nie da się precyzyjnie posegregować w szufladki i opisać wzorami matematycznymi. Można tutaj wspomnieć o różnicy między fizyką a chemią - wiemy przecież, że mają one ze sobą wiele wspólnego, ale fizyka to nauka opisująca świat wzorami, czego chemia stara się nie robić w tak dużej skali. Dzięki fizyce wiemy, że gdy ciało porusza się ruchem jednostajnym z prędkością v, to w czasie t przebędzie ono drogę S w przybliżeniu równą iloczynowi v oraz t. Chemia mówi, że dla różnicy elektroujemności powyżej 1,7 atomy tworzą wiązanie jonowe, ale z praktyki wiemy, że są związki kowalencyjne (spolaryzowane) o takich różnicach elektroujemności. Dążę do tego, że w chemii nie ma ostrych granic, szufladek i doskonałych wzorów, za to jest świat nas otaczający, który próbujemy opisywać w sposób najlepszy, jaki potrafimy.
Wracajmy jednak do tematu. Na czym polega różnica między teorią Bohra i falową? Główną różnicą, z której wszystko wynika jest odmienne spojrzenie na naturę elektronu. Zapewne już od dłuższego czasu wpajają Ci, że elektrony mają naturę falowo-korpuskularną. Skąd to wynika? A stąd, że dokładnie nie wiemy, jak "skonstruowany" jest elektron. Przyjmujemy, że w pewnych sytuacjach zachowuje się on jak materia, czyli ma zdolność do odbić sprężystych i posiada swoją masę, a w innych warunkach jest on falą (lub rozmytą chmurą ładunku ujemnego), która nie posiada masy. Zarówno na jedno jak i drugie zachowanie są dowody, więc przyjmujemy wspomnianą teorię na temat korpuskularno-falowej natury elektronu.
Dotychczas traktowaliśmy elektron jako cząstkę (małą piłeczkę krążącą po orbitach wokół jądra atomu). Twórcą takiej teorii był Bohr, który opracował także dość precyzyjny model atomu... niestety tylko wodoru. Była to swoista teoria, ponieważ było od niej więcej wyjątków niż faktów jej podległych. Potem zaczęto ją rozszerzać na kolejne pierwiastki, lecz z marnym skutkiem. Bardzo wiele faktów było przyjmowanych jako dogmaty i brak było ich uzasadnienia. Działo się tak do czasu wprowadzenia teorii falowej.
W teorii falowej elektron traktujemy jako falę (stąd nazwa). Elektron opisuje się liczbami kwantowymi (→ dalej), w związku z czym atom posiada pewien stan kwantowy. Opis stanów kwantowych wprowadził Erwin Schrödinger [əvɪn ʃrʏdingeə] za pomocą funkcji falowych, które są rozwiązaniem tzw. równania Schrödingera. Funkcja falowa opisuje prawdopodobieństwo znalezienia elektronu (obiektów kwantowych) w przestrzeni wokół jądrowej. Funkcja taka jest zależna od trzech parametrów nazywanych liczbami kwantowymi, które opisują stan kwantowy, a zostaną omówione w następnym podrozdziale.
Równanie Schrödingera dla atomu wodoru używane najczęściej ze względu na tzw. przybliżenie jednoelektronowe przybiera postać:
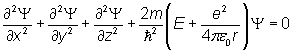
Gdzie Ψ to funkcja falowa, którą można wyznaczyć rozwiązując powyższe równanie. Kwadrat funkcji falowej Ψ2 jest ważną wielkością, która opisuje orbitale (→ dalej).
Ciekawy jest pogląd francuskiego fizyka Louisa Victora de Broglie [luɪs viktə de brɔɪl], który to stwierdził, że każda materia mogłaby zachowywać się jak fala. Podał on nawet zależność pomiędzy długością takiej hipotetycznej fali, a właściwościami związanymi z materią (fale de Broglie). Zależność ta ma postać:
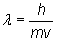
Wyjaśnia to dlaczego rozpatrujemy tą teorię dla cząstek o małej masie - dla ciężkich ciał długość fali jest bliska zeru. W chemii kwantowej symbolem h oznaczać będziemy stałą Plancka (h = 6,6260755⋅10-34 J⋅s).






