Addycja
Jest to jeden z typów reakcji organicznych. Poznałeś już spalanie, substytucję (S), czy eliminację (E). Teraz pora na addycję (A). Warto zapamiętać istotną różnicą pomiędzy substytucją (podstawieniem), a addycją (przyłączeniem): w reakcji substytucji zwykle z dwóch substratów powstają dwa produkty (reakcja podwójnej wymiany), natomiast addycja to proces, w którym z dwóch substratów powstaje jeden produkt (czyli jest to synteza). Produkt ten nazywamy adduktem.
Reakcja addycji dotyczy głównie* nienasyconych pochodnych węglowodorów. Jak pamiętasz są to takie, które zawierają wiązania wielokrotne, czyli podwójne i potrójne.
*) Wyróżnia się inne rodzaje addycji, np. addycję wody do bezwodników kwasowych.
Nie tracąc wiele czasu prześledźmy proces addycji na przykładzie bromu i etenu (dawniej etylenu).
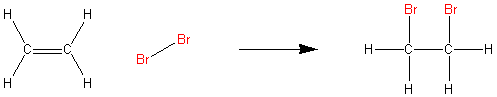
Przedstawiony powyżej proces nie jest, jak by to mogło wynikać z zapisu, procesem jednoetapowym. Procesy addycji, które będziemy rozpatrywać będą procesami o mechanizmie jonowym (tu nasuwa się wniosek, że biorą w nim udział jony, ale gdzie?).
Rozpatrzmy bardziej złożony przypadek przyłączenia wody to etenu.
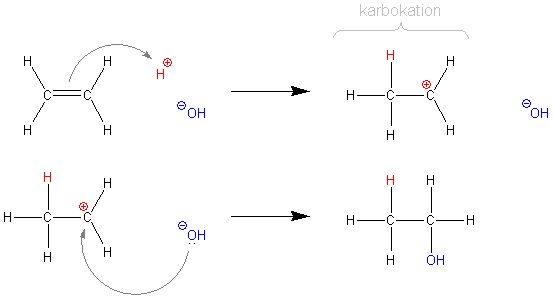
Na początku zachodzi proces, w którym bogate w elektrony wiązanie π (eten jest więc nukleofilem) atakuje proton pochodzący z rozpadu wody na jony. Proton jest zachłanny na elektrony (elektrofil). W tym procesie powstaje karbokation, czyli kation, w którym ładunek dodatni jest zlokalizowany na atomie węgla. Drugi etap to reakcja karbokationu z jonem OH−, co skutkuje powstaniem alkoholu etylowego.
Addycja wielokrotna
Rozważmy przyłączanie chloru do etynu. Proces ten zachodzi wieloetapowo: najpierw w dwóch etapach powstaje 1,2-dichloroeten:
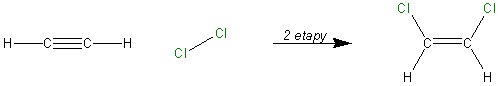
Powstały produkt jest dalej związkiem nienasyconym, dlatego może zachodzić dalsza addycja:
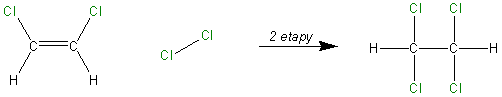
Natomiast jeśli ograniczy się stosownie (stechiometrycznie) ilość chloru proces zatrzyma się na 1,2-dichloroetenie
Tautomeria
Czasem zdarza się tak nietypowo, że addycja teoretycznie wielokrotna wcale taka nie jest, a za wszystko należy obwiniać proces tautomerii.
Rozpatrzmy następujący przypadek: przyłączanie wody do acetylenu (a raczej etynu).
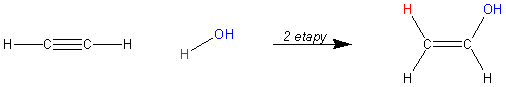
Powstały addukt jest związkiem zaliczanym do grupy enoli, czyli jak można wnioskować nienasyconych (-en) alkoholi (-ol) - dokładnie takich, w których grupa −OH znajduje się przy wiązaniu podwójnym.
Enole nie są trwałe i ulegają właśnie przekształceniu tautomerycznemu, które polega na tym, że wiązanie π przenosi się spomiędzy atomów węgla na wiązanie pomiędzy węglem a tlenem (silnie elektroujemny tlen ściąga elektrony π). Wodór przechodzi natomiast z tlenu na węgiel w celu zrównania wartościowości. Ilustruje to schemat na Ryc. 6.

Ryc. 6. Tautomeryzacja etenolu do etanalu
Powstały związek jest izomerem (tautomerycznym) etenolu. Jest to etanal należący do grupy aldehydów (stąd końcówka -al). O aldehydach powiemy więcej w dalszych rozdziałach.
Podobnie sytuacja ma się gdy uwodnimy propyn. Powstanie wtedy prop-1-en-2-ol (o tym dlaczego tak, a nie inaczej w następnym paragrafie). Związek ten ulega przekształceniu w aceton, który to jest pierwszym związkiem w szeregu homologicznym ketonów. O ketonach powiemy po aldehydach.
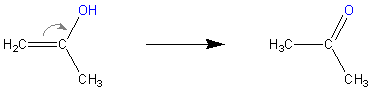
Ryc. 7. Tautomeryzacja prop-1-en-2-olu do propan-2-onu (acetonu)
Addycja niesymetryczna
Bardzo często bywa tak, że addycji ulegają dwie niesymetryczne cząsteczki. Pojawia się wtedy problem - jaki produkt otrzymujemy. Rozpatrzmy addycję chlorowodoru do propenu. Może ona zachodzić na dwa sposoby:
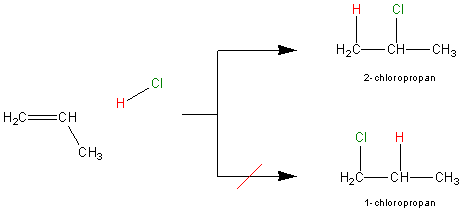
Przy czym dowiedziono, że po reakcji w próbce praktycznie nie dostrzega się 1-chloropropanu. Fenomen ten wynika z mechanizmu reakcji. Regulacje na temat tego, jakie produkty powstają w jonowej addycji do wiązania podwójnego znajdują się w kolejnym paragrafie.
Reguła Markownikowa
Reguła ta opisuje, w jaki sposób zachodzi addycja do wiązania podwójnego w cząsteczkach niesymetrycznych. Została opracowana przez rosyjskiego chemika, który nazywał się Владимир Васильевич Марковников (Vladimir Vasil'evich Markovnikov) w Polsce nazwany po prostu Markownikowem. Sprawdza się ona dla reakcji o mechanizmie jonowym (AE1 - addycja elektrofilowa jednocząsteczkowa).
Reguła ta ma kilka odmian. W celach szkolnych można zapamiętać, że "ci, którzy już mają dostaną jeszcze więcej", "każdy idzie do swojego" lub "wodór jest towarzyski", tzn. że jeśli przyłączamy do alkenu lub alkinu cząsteczkę HY, to wodór przyłącza się tam gdzie jest więcej wodoru, a element Y tam, gdzie jest go mniej. To uproszczenie nie zawsze się sprawdza. Znane są reakcje zachodzące niezgodnie z tą regułą (→ hydroborowanie).
W reakcjach addycji do alkenów lub aklkinów kation wodoru dołącza się do atomu, który jest najmniej zatłoczony, natomiast podstawnik anionowy dołącza się do bardziej podstawionego atomu węgla przy wiązaniu wielokrotnym.
Jakkolwiek byśmy interpretowali tę regułę powinniśmy dochodzić do jednego wyniku. Słuszność reguły Markownikowa tłumaczy się stabilnością powstających podczas addycji karbokationów, za co odpowiada hiperkoniugacja.
Hiperkoniugacja
Jest to zjawisko stabilizowania karbokationów. Ładunek dodatni w postaci pustego orbitalu p (patrz Ryc. 9) jest stabilizowany przez elektrony sąsiednich wiązań. Im wyższe podstawienie, tym ładunek dodatni jest lepiej stabilizowany, a cały karbokation bardziej trwały.
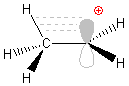
Ryc. 9. Hiperkoniugacja w kationie etylowym
Procesy stabilizacji są na tyle ważne, że w bardziej zaawansowanych przypadkach, kiedy wymuszona jest niekorzystna konfiguracja karbokationu, następują przegrupowania, ale nimi zajmować się na razie nie będziemy.






