Spalanie
Zacznijmy od definicji.
Spalanie to reakcja chemiczna polegająca na gwałtownym utlenianiu się substancji. Proces ten połączony jest z wydzielaniem ciepła (reakcja egzotermiczna) oraz fal elektromagnetycznych z zakresu widzialnego (światło).
Spalanie alkanów
Alkany jako jednej z niewielu ulegają reakcji spalania. Przykładowo metan ulega spalaniu wg schematu:
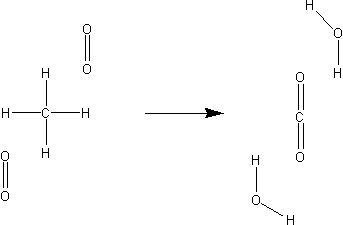
Opisuje to równanie:
CH4 + 2 O2 → CO2 + 2 H2O
Dwie cząsteczki tlenu przypadają na jedną cząsteczkę metanu (proporcje 2:1) - ten typ spalania nazywamy całkowitym, ponieważ powstaje najbardziej utleniony produkt. W sytuacji niedostatku powietrza (a tym samym tlenu) reakcja może przebiegać w inny sposób...
CH4 + 3/2 O2 → CO + 2 H2O
2 CH4 + 3 O2 → 2 CO + 4 H2O
Niby obie reakcje przedstawiają to samo, ale wersja pierwsza pozwala nam porównać ile tlenu przypada na jedną cząsteczkę metanu (proporcje 1,5:1 lub 3:2). Widać, że jest to ilość mniejsza, dlatego otrzymujemy produkt mniej utleniony. Jest to proces półspalania.
Związek o wzorze CO to tlenek węgla(II) popularnie nazywany czadem. Jest on bardzo niebezpieczny, ponieważ kształtem i budową przypomina cząsteczkę tlenu (Ryc. 2), dzięki czemu może on się przyłączać do hemoglobiny zamiast tlenu tworząc kompleks - karboksyhemoglobinę (HbCO). Kompleks HbCO jest trzystukrotnie mocniejszy od HbO2, dlatego hemoglobina nie odłącza już CO od siebie, a tym samym staje się bezużyteczna. Zatruty organizm dusi się.

Ryc. 2. Wzory tlenu i tlenku węgla(II)*
*) Wzory te należy traktować z przymrużeniem oka. Ani tlen, ani tlenek węgla nie wyglądają tak jak przedstawiono. Prawdziwa dirodnikowa struktura tlenu omówiona jest w materiałach dodatkowych: Budowa elektronowa cząsteczki O2 (•O−O•), zaś tlenek węgla wg jednej z teorii posiada dodatkowo wiązanie koordynacyjne od tlenu do węgla, aby osiągnąć oktet na atomie węgla (C≡O).
Wystarczy 0,1% CO w powietrzu, aby 50% Hb w ustroju zmieniło się w trwały kompleks HbCO.
Istnieje jeszcze jeden typ spalania. Jest to spalanie niecałkowite, w którym otrzymuje się sadzę, czyli czysty węgiel. Proces ten zachodzi przy dużym niedoborze powietrza (czyt. tlenu), co łatwo można dostrzec na równaniu:
CH4 + O2 → C + 2 H2O
Czyli stosunek wynosi tym razem 1:1. Zjawisko takie zdarza nam się często obserwować - nazywamy je kopceniem.
Ogólny zapis reakcji spalania
Ogólnie spalanie alkanów można zapisać jako:
- Spalanie całkowite:
2 CnH2n+2 + (3n+1) O2 → 2n CO2 + (2n+2) H2O - Półspalanie:
2 CnH2n+2 + (2n+1) O2 → 2n CO + (2n+2) H2O - Spalanie niecałkowite
2 CnH2n+2 + (n+1) O2 → 2n C + (2n+2) H2O
Można także zapisać ogólne wzory spalania dla wszystkich węglowodorów, co może przydać Ci się potem.
- Spalanie całkowite:
CcHh + (c + h/4) O2 → c CO2 + (h/2) H2O - Półspalanie:
CcHh + (c/2 + h/4) O2 → c CO + (h/2) H2O - Spalanie niecałkowite
CcHh + (h/4) O2 → c C + (h/2) H2O
Reakcja spalania jako metoda analizy chemicznej
Analiza chemiczna (gr. análysis 'rozkład') to szereg czynności prowadzący do odpowiedzi na dwa zasadnicze pytania: z czym mamy do czynienia i jaki jest skład chemiczny badanej próbki. Na pytanie pierwsze odpowiada chemiczna analiza jakościowa*, na drugie zaś odpowie chemiczna analiza ilościowa**, która to będzie nas teraz zajmować.
*) Jej celem jest wykrycie obecności pewnego składnika w badanej próbce
**) Jej celem jest ustalenie pełnego składu chemicznego badanej próbki z określeniem ilości każdego składnika
Załóżmy, że posiadamy pewien związek organiczny i chcemy dowiedzieć się, jaki jest jego skład i co to za związek. Narzędziem, które może nam pomóc jest reakcja spalania. Podstawowym warunkiem do jej wykorzystania jest fakt, czy dana substancja ulega spalaniu. Wiemy, że praktycznie wszystkie substancje organiczne ulegają spalaniu, a skoro tak, to możemy przystąpić do dzieła.
Należy odważyć pewną próbę badanej substancji (np. 100 g) i poddać działaniu wysokiej temperatury w obecności nadmiaru tlenu. W tych warunkach substancja ulegnie spaleniu. Wydzielą się różne gazy, które należy zebrać (pominiemy sposób ich zbierania).
Jednym z gazów będzie z pewnością CO2, bo wszystkie związki organiczne zawierają węgiel. Ze względu na to, że zapewniamy dostatnią ilość tlenu zachodzi spalanie całkowite. Zakładamy, że wydzieliły się 293 g tego gazu.
Kolejnym gazem, który z pewnością powstanie będzie para wodna H2O. Wprawdzie nie wszystkie związki organiczne zawierają wodór, ale tylko takie się palą, a to jest warunek. W naszym teście powstało 180 g wody.
Zadanie 1
W wyniku spalania 100 g pewnego węglowodoru powstały 293 g tlenku węgla(IV) i 180 g pary wodnej. Określ, co to za węglowodór.
Od razu widać, że reakcja zachodzi przy udziale tlenu, bo ani masy, ani skład pierwiastkowy po obu stronach równania nie zgadzałby się. Schemat postępowania jest praktycznie zawsze taki sam.
Ustalamy masę molową tlenku węgla(IV) i tlenku wodoru (wody).
MCO2 = 12 + 2 ⋅ 16 = 44
g/mol
MH2O = 2
⋅ 1 + 16 = 18 g/mol
Obliczamy ile moli tlenku węgla(IV) waży 293 g.
nCO2 = 293/44 = 20/3 mol
Wiemy już, że uzyskaliśmy w przybliżeniu 6,66 mol tlenku węgla(IV). Teraz możemy przeprowadzić analogiczne przeliczenie dla wody:
nH2O = 180/18 = 10 mol
Na podstawie tych informacji możemy wyznaczyć stosunek ilości atomów węgla do ilości atomów wodoru:
nC : nH = nCO2 : 2 nH2O = 20/3 : 2 ⋅ 10 = 1 : 3
nH2O trzeba było przemnożyć przez 2, ponieważ cząsteczka wody zawiera dwa atomy wodoru, dlatego moli atomów wodoru jest dwukrotnie więcej niż moli cząsteczek wody, które tworzą.
Teraz jesteśmy zdolni ustalić tzw. wzór empiryczny*:
CxH3x
Wzór ten opisuje nieskończenie wielką rodzinę związków jednak tylko jeden z nich istnieje. Spróbujmy wyliczyć kilku pierwszych przedstawicieli:
- CH3
- C2H6
- C3H9
- C4H12
CH3 to grupa metylowa, która z pewnością nie jest związkiem (nie może występować jako osobna substancja). C2H6 to etan i jest jak najbardziej prawidłowym alkanem. Dalsze "związki" jak C4H12 nie mogą istnieć, choć mogłoby to być np. 2 C2H6, ale takich sytuacji nie rozważamy.
Czasami szukany związek nie będzie na początku listy. Jeśli wiemy, że jest on alkanem, to jego poszukiwanie można znacznie uprościć porównując nasz wzór empiryczny z ogólnym wzorem alkanów.
CxH3x = CxH2x+2
Ilość węgla jest identyczna, musimy tylko porównać ilość wodoru.
3x = 2x + 2
x = 2
Próba poszukiwania związków takich jak alkeny (CxH2x), czy alkiny (CxH2x−2) zakończyłaby się klęską (w pierwszym wypadku równanie jest sprzeczne, w drugim x = −2, a takiej możliwości, w której związek posiada ujemną ilość atomów węgla nie dopuszczamy).
Odpowiedź: Szukanym związkiem jest etan (C2H6).
*) O wzorach mówiliśmy w rozdziale Wzory w tomie Chemia nieorganiczna.
W podobnych zadaniach jako gazy mogą również wydzielać się tlenki azotu (tzw. en-o-iksy od wzoru NOx) i amoniak, tlenki siarki (analogicznie es-o-iksy) i siarkowodór, tlenki fosforu i fosforowodór w związkach organicznych zawierających odpowiednio azot, siarkę i fosfor. Tlen w związkach organicznych określamy poprzez wyznaczenie brakującej masy.
Zadanie 2
W wyniku spalania 100 g alkanolu monohydroksylowego uzyskano 191,3 g tlenku węgla(IV) i 117,4 g pary wodnej. Określ, co to za alkohol.
Tym razem zacznę od opracowania wzoru ogólnego tego alkoholu. Informacja mówi, że jest to alkanol, czyli pochodna alkanu (nie alkenu, alkinu, polienu czy czegoś takiego). W dodatku ma tylko jedną grupę hydroksylową −OH. Wzór możemy tym samym opisać jako CxH2x+1OH, a na nasze potrzeby wystarczy CxH2x+2O.
Tak jak poprzednio wyznaczmy masy tlenku węgla(IV) i wody, wyznaczamy ilość moli nCO2 i nH2O, a potem nC = nCO2 i nH = 2 ⋅ nH2O.
nC = nCO2 = 100/23
mol
nH = 2 ⋅
nH2O = 300/23 mol
Wyliczamy stosunek.
nC : nH = 100/23 : 300/23 = 1 : 3
Czyli uzyskujemy wzór empiryczny.
CxH3xO
Porównujemy wzór empiryczny ze wzorem ogólnym.
CxH3xO = CxH2x+2O
I stwierdzamy, że musimy porównać ponownie tylko ilość wodoru.
3x = 2x + 2
x = 2
Czyli będzie to związek o wzorze: C2H6O, lub wyróżniając z niego grupę −OH - C2H5OH.
Odpowiedź: Szukany związek to etanol (C2H5OH).






