Izomeria konformacyjna
W alkanach istnieje możliwość rotacji dookoła wiązania C−C. Z tego względu mogą istnieć związki, które posiadają identyczne wzory strukturalne i takie samo połączenie atomów, ale ich rozmieszczenie w przestrzeni będzie różne. Jeśli takie różne ułożenie wynika z rotacji dookoła wiązania pojedynczego, to mówimy wtedy o konformerach (konformacyjnych izomerach). Izomerię konformacyjną można zaliczyć do izomerii przestrzennej zwanej stereoizomerią.
Konformery etanu
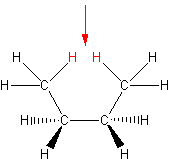
Aby oswoić się z problemem izomerii konformacyjnej przyjrzyj się obu wzorom stereostrukturalnym na Ryc. 1.
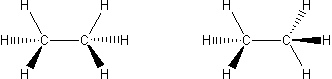
Ryc. 1. Wzory stereostrukturalne etanu
Jeśli nie pamiętasz jak należy je czytać cofnij się do rozdziału Wzory w tomie Chemia nieorganiczna. Jeśli wiesz, że grube kreski to wiązania wysunięte do Ciebie, zwykłe są na płaszczyźnie rysunku, a przerywane wchodzą pod nią - spróbuj wykonać model cząsteczki z plasteliny i zapałek. Obracaj jedną z grup CH3 tak, aby uzyskać raz jedną, raz drugą strukturę graniczną. Stosowne ruchome modele znajdują się pod http://www.uwosh.edu/~.
Poprzednie wzory można także przedstawić w perspektywie. Wzory takie, jak widoczne na Ryc. 2 nazywamy wzorami kozłowymi (lub konikowymi).
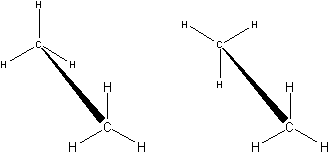
Ryc. 2. Wzory kozłowe (konikowe) etanu
Jeszcze inną metodą jest tzw. projekcja Newmana. W celu jej sporządzenia najpierw rysuje się "normalny wzór", a przy nim symbol oka - informujący, z której strony będziemy za chwilę pokazywać cząsteczkę. Następnie w wyobraźni obracamy ją tak, aby osoba przed rysunkiem znajdowała się w miejscu, które oznaczono symbolem oka i rysujemy diagram taki, jak ten na Ryc. 3 i Ryc. 4.
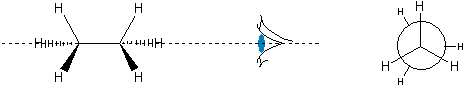
Ryc. 3. Projekcja Newmana naprzeciwległej konformacji etanu
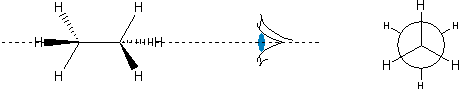
Ryc. 4. Projekcja Newmana naprzemianległej konformacji etanu
Przy czym duże koło oznacza tylny atom węgla. Przedni atom węgla to punkt, w którym zbiegają się trzy odcinki z przodu. Ze względu na poprawienie wyrazistości na Ryc. 3 i na podobnych projekcjach Newmana tylną grupę obraca się lekko, aby nie pokrywała się z przednią, jednak należy pamiętać, że ma się tu namyśli taką sytuację, w której właśnie te grupy na siebie zachodzą.
Naprężenie torsyjne
Musimy zaznaczyć, że aby móc mówić o izomerach, dany związek nie może przechodzić z jednej formy w drugą, jak mu się to podoba. Wtedy nie możnaby obserwować poszczególnych izomerów. Dlatego np. za izomery nie uznajemy struktur rezonansowych jak ozon, czy anion octanowy.
Co ogranicza rotację dookoła wiązania pojedynczego? Spróbujmy spojrzeć na ten problem przez cząsteczkę etanu.
Każda cząsteczka zbudowana jest z jąder atomów i chmur elektronowych, które ulegają deformacji i/lub delokalizacji. Na skutek wymienionych procesów powstają orbitale molekularne MO. Chmury ładunków ujemnych, jako że są jednoimienne (o jednakowym znaku −), odpychają się. Cząsteczka dąży do uzyskania najmniejszej wartości energii. W tym celu orbitale ustawiają się w przestrzeni tak, aby jak najsłabiej oddziaływać ze sobą, czyli jak najdalej od siebie.
Zobacz teraz ponownie Ryc. 3 i Ryc. 4, po czym zastanów się nad tym, który z konformerów jest niżej energetyczny, a tym samym bardziej stabilny. Odpowiedź na to pytanie nie jest trudna. Skoro na energię cząsteczki wpływają oddziaływania między atomami wodoru, to konformacja naprzemianległa powoduje stan niżej energetyczny.
Różnica energii konformeru naprzeciw- i naprzemianległego wynosi ok. 12 kJ/mol i stanowi barierę swobodnej rotacji w cząsteczce etanu. Energia ta nazywana jest naprężeniem torsyjnym. Im naprężenie torsyjne jest większe, tym prawdopodobieństwo odchylenia od struktury najniżej energetycznej jest mniejsze. 12 kJ/mol to nie wiele, więc można rokować, że etan dość silnie odchyla się od konformacji naprzemianległej.
Konformacje butanu
Tak samo jak etan, zarówno propan, butan i inne związki organiczne, które posiadają wiązania pojedyncze mają swoje izomery konformacyjne.
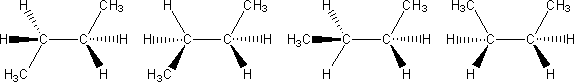
Ryc. 5. Wzory stereostrukturalne konformerów butanu (kolejno: 180°, 120°, 60°, 0°)
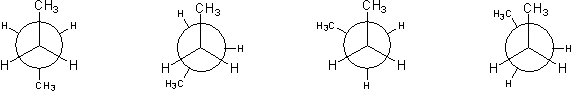
Ryc. 6. Projekcje Newmana konformerów butanu (kolejno: 180°, 120°, 60°, 0°)
Rozpatrując konformery n-butanu przy tworzeniu projekcji Newmana spoglądaliśmy wzdłuż środkowego wiązania C−C. Przykład dla konformacji antyperiplanarnej (180°) prezentuje Ryc. 7.
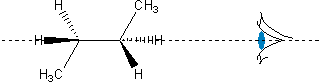
Ryc. 7. Widok na projekcję Newmana w n-butanie
Naprężenie steryczne
Konformery n-butanu mają swoje nazwy w zależności od kąta jaki zawarty jest pomiędzy grupami metylowymi. 180° to konformacja antyperiplanarna, 60° synklinarna, 0° synperiplanarna. Dla uproszczenia posługiwać się będziemy jednak wartościami tych kątów.
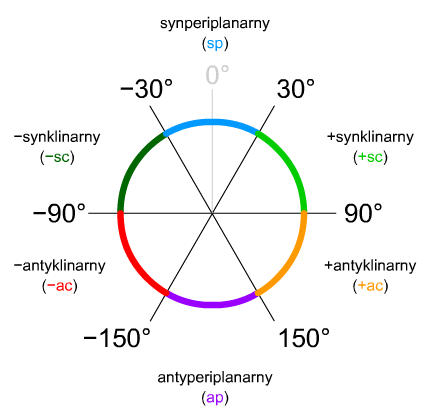
Ryc. 8. Nazwy kątów torsyjnych (ang. torsion angle)
Wiemy już że konformacje naprzeciwległe (120° i 0°) są mniej trwałe od naprzemianległych (180° i 60°). Ale czy nawet mniej trwałe 120° i 0° są równocenne? Okazuje się, że nie. Oprócz naprężenia torsyjnego występuje też inne - naprężenie steryczne. Powstaje ono kiedy grupy funkcyjne fizycznie sobie przeszkadzają zachodząc na siebie.
Naprężenie steryczne pojawia się w konformacji 60° i 0° oraz pomiędzy nimi a także w dalszej rotacji aż do 60° po drugiej stronie. Im bliżej konformacji 0° tym naprężenie steryczne jest silniejsze i tym większa energia jest potrzebna do osiągnięcia takiego kształtu.
Naprężenie torsyjne i steryczne współdziałają znacznie ograniczając rotację w cząsteczce n-butanu.
Konformery cykloheksanu
Także związki pierścieniowe takie jak cykloheksan mają swoje konformery. Jak myślisz który konformer: łódkowy czy krzesłowy jest bardziej stabilny?
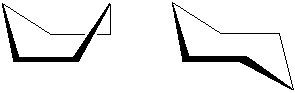
Ryc. 10. Kolejno: łódkowa i krzesłowa konformacja cykloheksanu
Oczywiście w pierścieniu łódkowym występują większe naprężenia, dlatego forma krzesłowa jest trwalsza i właśnie taką praktycznie zawsze rysujemy (→ cukry). Bardziej dokładne omówienie tego problemu znajduje się przy cykloalkanach.
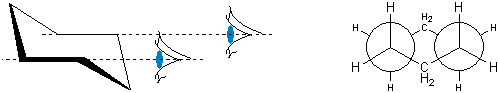
Ryc. 11. Projekcja Newmana łódkowej konformacji cykloheksanu






