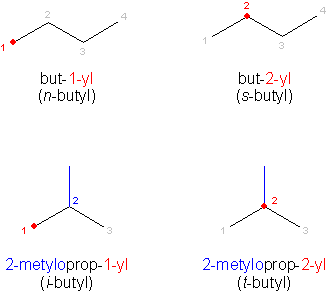Alkany
Alkany to węglowodory alifatyczne, czyli związki powstałe z połączenia tylko atomów węgla i wodoru w najrozmaitszy sposób. Pojęcie alifatyczny znaczy tyle, co acykliczny, czyli niepierścieniowy. Więc alifatycznymi nazwiemy te węglowodory, które będą tworzyły niedomknięte łańcuchy. Niedługo wszystko się wyklaruje.
Metan
O węglowodorach można powiedzieć, że są to najprostsze związki organiczne. Z kolei najmniej skomplikowanym z nich jest pięcioatomowy metan. Gaz ten zawiera centralnie umiejscowiony atom węgla i cztery atomy wodoru dookoła.
Atom węgla w cząsteczce CH4 występuje w hybrydyzacji sp3, czyli cząsteczka przybiera kształt przestrzenny opisywany jako tetraedryczny (czworościenny).

Ryc. 1. Metan
Wygląd orbitali molekularnych (MO) cząsteczki metanu przedstawia Ryc. 2. Na podstawie eksperymentu udowodniono, że wiązania w cząsteczce metanu są zdegenerowane (równocenne). Są to wiązania typu czołowego σsp-s. Kąt φ to kąt tetraedryczny (φ = 109°28′).
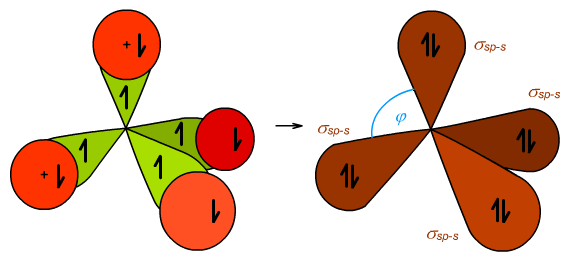
Ryc. 2. Orbitale molekularne metanu
Różnica elektroujemności pomiędzy pierwiastkami tworzącymi wiązanie C−H wynosi ok. ΔχC−H = 2,5 − 2,1 = 0,4. Tym samym polaryzacja wiązań metanu jest bardzo niewielka, a na dodatek znosi się, więc nie obserwujemy momentu dipolowego - cząsteczka nie jest polarna. Metan i inne węglowodory nie rozpuszczają się w wodzie, ponieważ nie mogą z nią oddziaływać (brak polaryzacji).
Metan stanowi minimum 75% gazu ziemnego. Dlatego gaz ziemny jest przemysłowym źródłem metanu. Inne sposoby otrzymania metanu ilustrują równania reakcji:
C + 2H2 500°C→ CH4
CO + 3 H2 → CH4 + H2O
CH3COONa + NaOH → CH4 + Na2CO3
Al4C3 + 12 HCl → 3 CH4 + 4 AlCl3
Druga reakcja wykorzystuje wzbogacany wodorem gaz do syntez. Otrzymywanie gazu do syntez polega na sprzężonym spalaniu węgla (w celu wytworzenia potrzebnej energii) i reakcji węgla z wodą. Dodatkowy wodór wywiązywany jest w procesie elektrolizy wody.
2C + O2 → 2 CO + E
C + H2O + E → CO + H2
2 H2O V→ 2 H2 + O2
Etan
Atomy węgla mogą się także łączyć pomiędzy sobą tworząc większe cząsteczki. Etan to związek zawierający osiem atomów (C2H6). Tak, jak we wszystkich związkach organicznych atomy węgla etanu są czterowartościowe i jak to jest we wszystkich alkanach występują w hybrydyzacji sp3.

Ryc. 3. Etan
Wygląd orbitali molekularnych (MO) cząsteczki etanu przedstawia Ryc. 4. Wiązania C−H są typu czołowego σsp-s, a wiązanie C−C to także wiązanie czołowe, ale σsp-sp. Kąty są identyczne jak w cząsteczce metanu - φ = 109°28′.
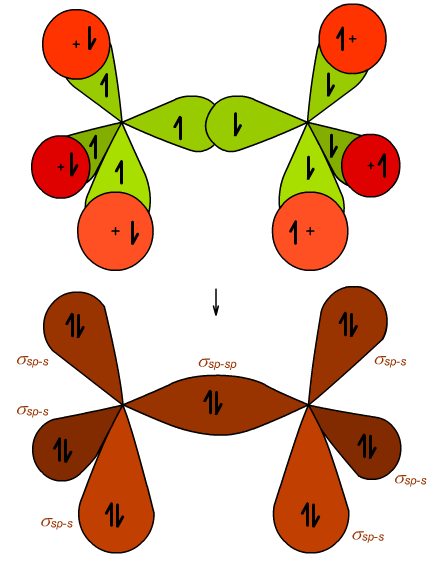
Ryc. 4. Orbitale molekularne etanu
Szereg homologiczny alkanów
Następne atomy wodoru mogą być podmieniane atomami węgla, przez co powstają coraz dłuższe łańcuchy węglowodorowe. Przy czym zawsze zachowana jest czterowartościowość węgla. Rozpatrzmy kolejne przykłady związków o łańcuchach z trzema, czterema i pięcioma atomami węgla. Przy rysowaniu ich wzorów będziemy posługiwać się wzorami strukturalnymi nieoddającymi struktury przestrzennej związku.
Często stosowane zestawienie można znaleźć w poniższej tabeli. Opisuje ono tzw. szereg homologiczny n-alkanów. Szereg homologiczny to grupa związków o pewnych cechach wspólnych, które wymienimy za chwilę. Na razie przyjrzyj się i spróbuj sam stwierdzić, jakie są podobieństwa, a jakie różnice pomiędzy kolejnymi związkami szeregu homologicznego n-alkanów. n-Alkany to alkany o prostych łańcuchach węglowodorowych. Można sobie łatwo wyobrazić inne cząsteczki, ale o tym powiemy przy izomerii łańcuchowej węglowodorów.
| Ilość at. węgla | Nazwa | Wzór strukturalny | Wzór sumaryczny |
|---|---|---|---|
| 1 | metan | 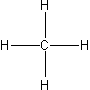 |
CH4 |
| 2 | etan | 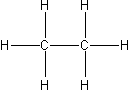 |
C2H6 |
| 3 | propan | 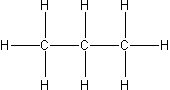 |
C3H8 |
| 4 | n-butan | 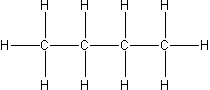 |
C4H10 |
| 5 | n-pentan | 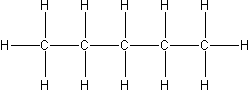 |
C5H12 |
Szereg homologiczny alkanów (1 do 5 atomów węgla)
Najsilniej nasuwającą się różnicą jest ilość atomów węgla w cząsteczce kolejnych związków, która zmienia się regularnie - wzrasta o 1. Liczba wodoru także wzrasta regularnie - o 2. Jeśli się przyjrzeć łatwo można stwierdzić, wszystkie elementy podporządkowują się wzorowi ogólnemu:
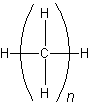
Przy czym dla metanu n = 1, etanu n = 2, propanu n = 3 itd... Stąd wynika definicja szeregu homologicznego.
Szereg homologiczny - grupa związków organicznych podobna do siebie pod względem struktury. Kolejne związki w szeregu homologicznym różnią się od siebie ilością grup metylenowych −CH2−. Związki należące do jednego szeregu homologicznego nazywamy homologami. Związkom szeregu homologicznego można przypisać wspólny wzór ogólny.
Wzór ogólny alkanów w postaci półstrukturalnej to H−(CH2)n−H, lub po prostu sumarycznie CnH2n+2. Wnioskujemy z tego, że cząsteczki zawierają dwukrotnie więcej atomów wodoru niż węgla i jeszcze dwa atomy wodoru na końcach łańcucha.
Nazwy alkanów są tworzone od liczebników greckich określających ilość atomów węgla w łańcuchu (oprócz pierwszych czterech) oraz końcówki -an.
| Liczba | Liczebnik grecki |
Alkan |
|---|---|---|
| 1 | mono (hen)* | metan |
| 2 | di (do)* | etan |
| 3 | tri | propan |
| 4 | tetra | butan |
| 5 | penta | pentan |
| 6 | heksa | heksan |
| 7 | hepta | heptan |
| 8 | okta | oktan |
| 9 | nona | nonan |
| 10 | deka | dekan |
| 11 | undeka | undekan |
| Liczba | Liczebnik grecki |
Alkan |
|---|---|---|
| 12 | dodeka | dodekan |
| 13 | trideka | tridekan |
| 20 | ejkoza | ejkozan |
| 21 | henejkoza | henejkozan |
| 22 | dokoza** | dokozan |
| 30 | triakonta | triakontan |
| 40 | tetrakonta | tetrakontan |
| 80 | oktakonta | oktakontan |
| 100 | hekta | hektan |
| 300 | trikta | triktan |
| 1000 | kilia | kilian |
*) Służy do tworzenia nazw liczebników wyższych (np.: 11, 21, 22)
**) W liczebnikach 22-29 pomija się fragment -ej-
Przy omawianiu każdego szeregu mówi się o podobieństwach i różnicach dotyczących struktury, właściwości fizycznych i właściwości chemicznych.
Struktura alkanów:
- Tworzą rozbudowane przestrzennie łańcuchy proste lub rozgałęzione
- Atomy węgla przybierają hybrydyzację tetragonalną sp3
- Występuje rotacja dookoła wiązań C−C
- Różna ilość grup metylenowych −CH2−
Właściwości fizyczne alkanów:
- Hydrofoby (są niepolarne)
- Lotne (od CH4 do C4H10 - gazy, od C5H12 do C15H32 - ciecze, ponad C16H34 - nisko topliwe ciała stałe)
- Rozpuszczają się same w sobie i w podobnych do nich (niepolarnych) rozpuszczalnikach głównie organicznych
- Są łatwopalne
Właściwości chemiczne alkanów:
- Ulegają reakcjom spalania
- Ulegają reakcjom podstawienia (substytucji halogenami)
- Są bierne chemicznie (mało reaktywne)
Wszystkie te punkty zostaną omówione w dalszej tomu.
Alkile
W chemii organicznej często wyróżniamy podstawniki. Jeśli są to grupy atomów, których obecność powoduje pewne właściwości, to mówimy o grupach funkcyjnych (o nich pomówimy przy alkoholach). Podstawnikiem może być także inna grupa atomów, np. tzw. alkil.
Alkil to jednowartościowa grupa atomów wywodząca się z węglowodorów. Przykładowo alkil metylowy pochodzący od metanu to metyl CH3·. Kilka przykładów prezentują poniższe rysunki. Alkile posiadają końcówkę -yl z lokantem wskazującym miejsce przyłączenia do dalszej części cząsteczki.
Istnieje tylko jeden metyl.
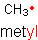
Ale są dwa propyle. Jeden z nich normalny, czyli n-propyl (prop-1-yl), a drugi to prop-2-yl, czyli izopropyl. W nomenklaturze alkili preferowane są jednoliterowe oznaczenia struktury. Tak więc izopropyl zapisuje się jako i-propyl. Spotykane są też nazwy typu 2-propyl, itd.

W przypadku alkilu butylowego sprawa komplikuje się jeszcze bardziej. Mamy zwykły n-butyl. Podstawiony na drugiej pozycji to sec-butyl, czyli zgodnie z jednoliterowymi oznaczeniami s-butyl. Następnie metylopochodna propanu izobutyl, czyli i-butyl oraz podstawiony przy trzeciorzędowym atomie tert-butyl, czyli t-butyl.