Odmiany alotropowe węgla
Przy okazji omawiania węgla powiedzmy, że węgiel posiada kilka odmian alotropowych. Jeszcze niedawno powiedzielibyśmy, że jest to grafit i diament, ale przez kilka ostatnich lat odkryliśmy wiele nowych odmian krystalicznych. Przepraszam, że nie omawiam wszystkich, ale mnogość tych odmian jest przytłaczająca.
Węgiel występuje w następujących odmianach alotropowych:
- Grafit
- α heksagonalny
- β romboedryczny (trygonalny)
- grafitowe wąsy (whiskers)
- Diament
- diament
- lonsdaleit (diament heksagonalny)
- Fulereny
- fulereny
- nanorurki
- nanocebulki
- Nanopianka
- Karbiny
- chaoit (poliyny)
- kumulen
- cyklokarbon
- n-Karbon
- Karbon IV
- Odmiany bezpostaciowe (sadza)
Dobre ilustracje 2D pod http://www.rie.shizuoka.ac.jp/~, jednak polecam widok 3D struktur. Stosowną grafikę 3D znajdziesz na http://www.nyu.edu/~ - wymaga Javy, lub http://www.nyu.edu/~ - wymaga Chime (Chime przydaje się, gdyż jest podstawowym narzędziem do wizualizacji cząsteczek, jeżeli chodzi o Internet na całym świecie).
Grafit
Grafit to substancja o barwie grafitowej (szaro-czarnej z metalicznym połyskiem). Mało reaktywna, gęstość wynosi ok. 2,3 g⋅cm-3. Grafit zawiera atomy węgla w hybrydyzacji sp2. Wszystkie atomy powiązane są trzema wiązaniami kowalencyjnymi (∠ 120° długość 1,42 Å) tworząc ogromną sieć w postaci płaszczyzny. Każdy atom posiada jeden niesparowany elektron na niezhybrydyzowanym orbitalu p dzięki któremu grafit przewodzi prąd elektryczny. Strukturę grafitu prezentuje Ryc. 1.
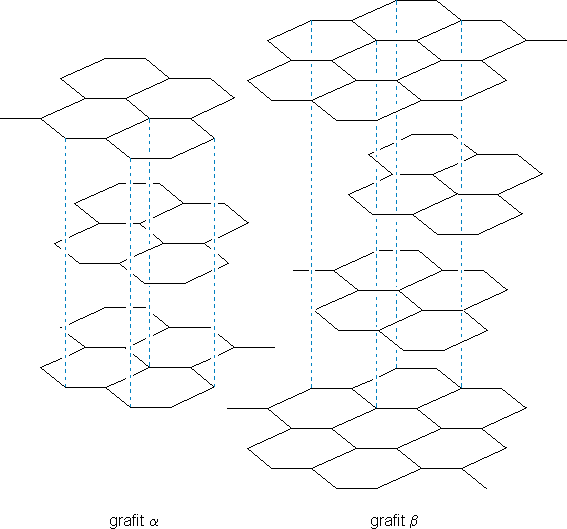
Ryc. 1. Struktura grafitu α i β
Warstwy są ze sobą luźno związane za pomocą sił Londona i oddalone o 3,35 Å, dlatego łatwo mogą się od siebie oddzielać. Grafit został zastosowany w ołówkach, ponieważ jego warstwy się ścierają i pozostają na porowatym papierze. Stosuje się go także do wyrobu elektrod, tygli i in., ponieważ jest odporny na wysoką temperaturę. Grafit w skali Mohsa* posiada twardość 1.
*) Mohsa skala twardości - dziesięciostopniowa skala twardości głównie minerałów. Materiał o danej twardości rysuje materiały położone w skali niżej i jest rysowany prze te, które są w skali wyżej.
Grafit występuje w dwóch odmianach: α i β. Mają one takie same właściwości fizyczne, różnią się jednak strukturą kryształów. Grafit heksagonalny (ang. hexagonal) to forma α zaś forma β to grafit trygonalny, czyli romboedryczny (ang. rhombohedral).
Naturalny grafit zawiera około 70% formy α i 30% formy β oraz inne domieszki. Natomiast grafit syntetyczny to czysta forma α. Formy te oczywiście można zamieniać jedna w drugą. Grafit α można zamienić w formę β poprzez odpowiednie operacje mechaniczne. Grafit β przechodzi samoczynnie w formę α przy ogrzewaniu do temperatur przekraczających 1000°C.
Dodatkowo w 1998 roku w Northeastern University in Boston zostały stworzone grafitowe wąsy (ang. graphite whiskers). Są to struktury, które podobnie jak nanorurki powstają przez zwinięcie płaszczyzny grafitu, ale w inny sposób. Nanorurka powstaje tak, jakbyśmy skleili dwa naprzeciwległe boki kartki. Natomiast whiskers powstają tak, jakbyśmy skręcali kartkę w tutkę.
Diament
Bardzo ceniona odmiana alotropowa węgla. Jest to jeden z twardszych związków, ponieważ diament tworzy kryształy kowalencyjne - wszystkie wiązania są kowalencyjne (∠ 109°28′, 1,54 Å, atom węgla w hybrydyzacji sp3).
Diament w skali Mohsa posiada twardość najwyższą - 10, co w porównaniu do grafitu jest zadziwiające. Jego gęstość to 3,5 g/cm3. Jest półprzewodnikiem elektryczności i dobrym przewodnikiem ciepła, trudno topliwy, odporny na działanie ługów i kwasów. W dużych temperaturach przechodzi w grafit.
Czysty diament jest bezbarwny i niezależnie od domieszek - przezroczysty. Domieszki powodują zabarwienie diamentów i tym samym powstawanie różnych kamieni szlachetnych. Oszlifowany diament zwany jest brylantem, rautem lub rozetą, co zależy od sposobu oszlifowania.
Największy diament (naturalny) ważył 3106 karatów, ale to tylko część (zapewne połowa) większej bryły - innych fragmentów nie odnaleziono. Wykonano z niego największy brylant - Gwiazdę Afryki o masie 530 karatów. Jest oprawiony w brytyjskie berło. Z diamentu giganta wykonano jeszcze 104 inne brylanty. Przy szlifowaniu utracono ponad połowę masy diamentu wyjściowego.
Karat jest dawną jednostką zwyczajowo używaną o określania masy kamieni szlachetnych. 1 kar = 0,2 g . Polecam lekturę: http://www.pgi.gov.pl/~ na temat diamentów.
Lucy - kosmiczny diament
W kosmosie miga gwiazda o astronomicznej wadze 10 kwadryliardów karatów. Astronomowie zastosowali dla niej jubilerską miarę wagi, bo odkryty obiekt, to nic innego jak gigantyczny diament. Gwiazda jest bryłą skrystalizowanego węgla o średnicy 1500 km, stosunkowo blisko naszej planety, bo w odległości 50 lat świetlnych. Należy do konstelacji Centaura.
16.2.2004 17:43 (CET)
Inną odmianą diamentu jest lonsdaleit zwany diamentem heksagonalnym. Różni się on nieznacznie strukturą kryształu kowalencyjnego.
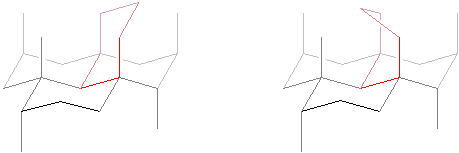
Ryc. 2. Od lewej fragmenty sieci kryształu diamentu i lonsdaleitu
Fulereny
To jedno z nowszych odkryć. Dlatego warto mu poświęcić troszkę czasu. Ta oto odmiana alotropowa została odkryta w 1985 roku przez Roberta Curla [kəːl], Richarda Smalleya [smɒːlej] i Harolda Kroto. W 1990 roku po raz pierwszy otrzymano fulereny syntetycznie. W 1996 roku panowie otrzymali za swoje odkrycie Nagrodę Nobla.
Fulereny naturalnie można spotkać w szungicie (minerał) i strzałkach piorunowych - tworach powstałych w miejscu uderzenia pioruna w ziemię.
Nazwa została nadana na cześć budowniczego Buckminstera Fullera, który to konstruował kopuły do złudzenia przypominające odkryte związki. Pełna nazwa fulerenów z ang. buckminsterfullerene. Stąd nazwa zwyczajowa - buckyball.
Fulereny składają się z parzystej ilości atomów węgla. Ich kształt często przypomina kulę lub sferoidę*. Najtrwalsze i najczęściej spotykane to: C60 i C70. Ten pierwszy jest nazywany jest futbolanem ze względu na kształt, który dla piłki futbolowej jest taki sam. Podobieństwo dostrzeżesz z łatwością na Ryc. 3.
*) Sferoida (elipsoida obrotowa) - bryła powstała przez obrót elipsy dookoła małej osi
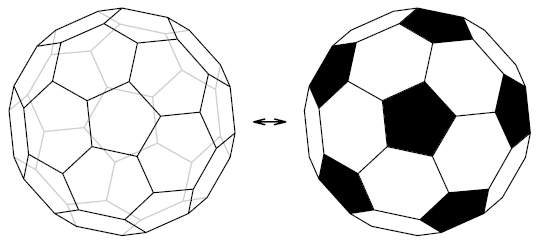
Ryc. 3. Model cząsteczki fulerenu C60 i przyrównanie do piłki futbolowej
Każdy atom węgla w cząsteczce jest czterowiązalny, czego nie widać na poprzednim rysunku, dlatego teraz kolejny rysunek w formie nienasyconej (ang. unsaturated form), gdzie widać wiązania podwójne - Ryc. 4. Nie stosuje się takiego zapisu, ponieważ wiązania podwójne są ruchome, a orbitale molekularne - zdelokalizowane. My także będziemy się posługiwać schematami z wiązaniami pojedynczymi pomijając ogromny orbital ze zdelokalizowanymi elektronami wewnątrz piłki.
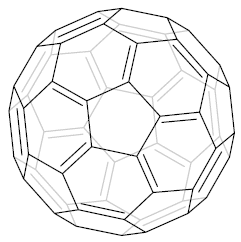
Ryc. 4. Nienasycona forma wzoru cząsteczki fulerenu C60
Można "rozpłaszczyć" fulereny i przedstawić na płaszczyźnie w postaci diagramu Schlegela*. Kolejne obrazki prezentują takie rozpłaszczone formy Schlegela
*) Sposób prezentacji bryły na płaszczyźnie. Opis w języku angielskim: http://www.ac-noumea.nc/~.
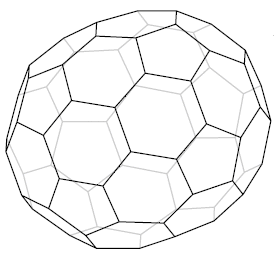
Ryc. 5. Fuleren C70
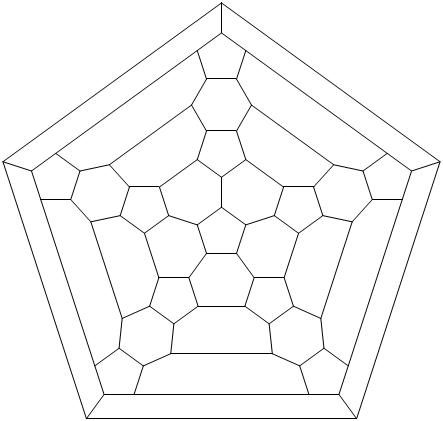
Ryc. 6. Diagram Schlegela fulerenu C70
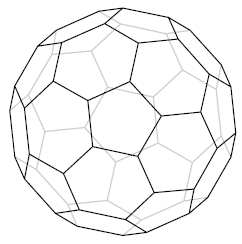
Ryc. 7. Fuleren C60
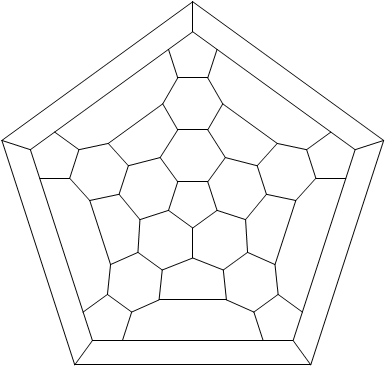
Ryc. 8. Diagram Schlegela fulerenu C60
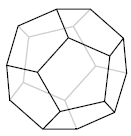
Ryc. 9. Fuleren C20
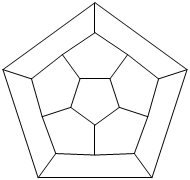
Ryc. 10. Diagram Schlegela fulerenu C20
W sieci: program Poly pozwala na oglądanie brył, ich siatek i diagramów Schlegela. Można go ściągnąć z tej strony: http://www.peda.com/. Nie pozwala on niestety na oglądanie większych brył jak C60. Informacje á propos nazewnictwa, oraz sporo ilustracji związków fulerenopochodnych znajdziesz pod http://www.chem.qmul.ac.uk/~. A na tej stronie o fulerenach w medycynie: http://www.sciencenews.org/~. Na http://www.rie.shizuoka.ac.jp/~ i http://micro.magnet.fsu.edu/~ znajdują się obrazki, na http://www.nyu.edu/~ widok 3D, a na http://molecularexpressions.com/~ zdjęcia spod mikroskopu - fulerenu C60. Na stronie http://www.sevenravens.com/~ można znaleźć program do symulacji zderzeń fulerenów. Zaś pod http://serwisy.gazeta.pl/~ znajduje się kilka artykułów o fulerenach i nanorurkach.
Przede wszystkim jednak polecam artykuł "lekki, łatwy i przyjemny": Fulereny - nowa odmiana alotropowa węgla. A do tego ilustracja: Produkcja i separacja fulerenów.
Możesz wykonać własny model fulerenu C60. Aby to zrobić - wydrukuj (lub przeszkicuj) na sztywny papier zawartość poniższego pliku PDF (przydatny może okazać się szablon sześciokąta - konstrukcja), natnij na falowanych liniach i sklej zaginając strukturę w kulkę. Niektóre ściany będą się nakładać. Postaraj się, aby model był jak największy - łatwiej będzie go skleić.
Nanocebulki
Możliwe, że zauważyłeś różnicę w kształcie C60 i C70. Pierwszy to kula, drugi to sferoida, czyli coś na kształt jajka. Kolejne fulereny są coraz bardziej kanciaste. Możliwe też, że nasunęło Ci się na myśl, co by było, gdyby zamknąć jeden fuleren w drugim, albo wpakować jeszcze kilka do środka (oczywiście mniejszych). Otóż takie struktury istnieją - nazywamy je nanocebulkami (ang. nano-onions). Jest to jednak słabo poznana grupa fulerenów (model).
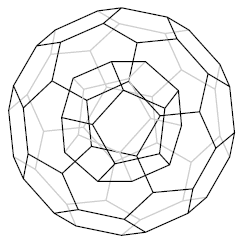
Ryc. 11. Prosta nanocebulka C20·C60.
Powyższa nanocebulka nie jest do końca prawidłowa, ponieważ teoretycznie nanocebulki wyglądają tak (wg Kroto):
Cx · C4x · C9x · C16x · ... · Cx⋅n2
Nanorurki
Bliskimi kuzynami kulistych fulerenów są nanorurki. Nanorurki zostały odkryte tak jak fulereny praktycznie przez przypadek. Miało to miejsce w 1991 roku, gdy Sumoi Iijima otrzymywał fulereny w NEC Corporation. Tam też w rok później opracowano metodę syntezy nanorurek. Z czasem powstaną elementy elektroniczne oparte na nanorurkach.
Prezentacja o nanorurkach http://www.if.pw.edu.pl/~.
Nanorurki to struktury węglowe wyglądające jak bardzo rozciągnięte fulereny. Kształt ich przypomina tubę (ang. nano-tubes), czyli pusty walec. Ich zakończenia przypominają fulereny (są kuliste). Często mówi się, że nanorurka to zwinięta płaszczyzna grafitu sklejona brzegami.
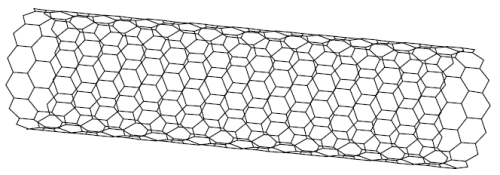
Ryc. 12. Przykładowa nanorurka
Odsyłam pod polski adres http://fulereny.olimp.ceti.pl/~, gdzie o fulerenach i nanorurkach znajdziesz bardzo dużo informacji.
Nanopianka
Nanopianka (ang. nano-foam, foam 'piana') to odmiana alotropowa węgla, która została odkryta w 2004 roku. Otrzymano jak już to mamy w naszym zwyczaju sztucznie poprzez strzelanie promieniami lasera o częstotliwości f = 10.000 Hz w temperaturze 10.000°C.
W tych warunkach naukowcom z Australian National University w Canberrze udało się otrzymać bardzo lekkie ciało stałe (ρ = 2 g⋅cm-3).
John Giapintzakis z uniwersytetu na Krecie przeprowadził obserwacje pod mikroskopem elektronowym i stwierdził, że otrzymana substancja jest kolejną krystaliczną odmianą węgla (odmianą alotropową).
Okazuje się, że nanopianka początkowo jest przyciągana przez magnes (pomimo, że węgiel uważa się za diamagnetyk). Właściwości magnetyczne znikają po kilku godzinach. Wiemy że węgiel może nas zaskakiwać - jego odmiany alotropowe są tak różne.

Ryc. 13. Fotografia spod mikroskopu węgla pod postacią nanopianki.
Kilka linków zewnętrznych:
Karbiny
Karbiny to węgle w hybrydyzacji sp. Wyróżnia się kilka ich typów.
Poliyny (ang. polyynes) to długie węglowe łańcuchy ze sprzężonymi wiązaniami potrójnymi (na przemian z pojedynczymi). Ich strukturę przedstawia Ryc. 14. Szerzej poliyny będą omówione przy alkinach (→ alkiny).
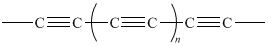
Ryc. 14. Struktura poliynów
Naturalnie występują one w postaci minerału zwanego chaoitem. Inny rodzaj karbinów to kumuleny czyli polieny skumulowane o strukturze:
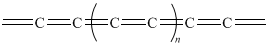
Ryc. 15. Struktura kumulenów
W podobny sposób wyglądają cykliczne cyklokarbony z podwójnymi wiązaniami skumulowanymi. Rycinę pominę.
Odmiany bezpostaciowe
W odmianach bezpostaciowych (ang. amorphous carbon 'węgiel amorficzny') atomy węgla nie tworzą żadnych konkretnych ugrupowań (kryształów). Czołowym przedstawicielem węgla amorficznego jest sadza.







