Atom węgla
Wiemy już, że najważniejszą częścią związków organicznych jest węgiel. On właśnie będzie tworzył szkielety cząsteczek, którymi będziemy się zajmować. Dlatego omówimy teraz sam atom węgla.
Pierwiastek węgiel został umieszczony w układzie okresowym w drugim okresie i czternastej grupie (dawniej IV A). Jego atom posiada sześć elektronów w tym cztery walencyjne (na ostatniej powłoce).
Konfiguracja atomu węgla w stanie podstawowym:
6C: 1s2 2s2 2p2
| s | p | |
| 1 K | 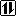 |
|
| 2 L | 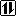 |
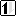
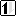
 |
W momencie, kiedy atom węgla chce stworzyć wiązania - hybrydyzuje (→ Chemia kwantowa). Najpierw przechodzi w stan wzbudzony, co na konfiguracji objawia się przeskokiem jednego z elektronów 2s2 na jedną z pustych podpowłok p.
6C*: 1s2 2s1* 2p3*
| s | p | |
| 1 K | 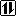 |
|
| 2 L | 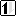 |
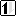
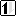
 |
Za pomocą gwiazdki * przyjęło się oznaczać stany kwantowe wyżej energetyczne, atomy w stanie wzbudzonym, czy orbitale antywiążące. Ogólnie wszystko, co wiąże się z nadmiarem energii.
Na podstawie prezentowanych konfiguracji widzimy, że atom węgla posiada cztery niesparowane elektrony na orbitalach 2s i 2p. Aby symetrycznie zapełnić orbitale elektronami potrzebuje on kolejnych czterech elektronów na powłokę walencyjną (zaznaczone na szaro).
W tej chwili orbitale atomu węgla prezentuje Ryc. 1. Oczywiście obie części należałoby nałożyć na siebie, ale nie robię tego, aby rysunek był bardziej czytelny.
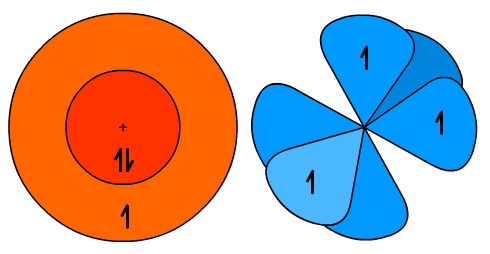
Ryc. 1. Orbitale wzbudzonego atomu węgla przed hybrydyzacją
Następnie przed związaniem atomu węgla zachodzi proces hybrydyzacji. Węgiel może hybrydyzować sp, sp2 i sp3. W związkach organicznych nie obserwuje się niezhybrydyzowanych atomów węgla.
Rodzaj hybrydyzacji jest zależny od tego ile wiązań π musi wytworzyć atom przy wiązaniu się w związki. Jeśli nie tworzy wiązań π - hybrydyzacja sp3, gdy tworzy jedno wiązanie π - hybrydyzuje sp2, gdy są dwa wiązania π - obserwujemy hybrydyzację sp.
Tworzenie pojedynczej hybrydy sp
Pojedyncza hybryda sp tworzy się poprzez nałożenie jednego orbitalu s i jednego orbitalu p. Proces ten ilustruje Ryc. 2.
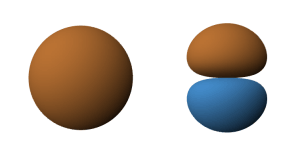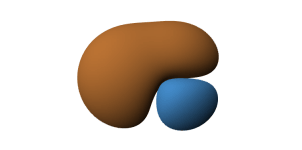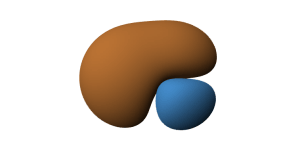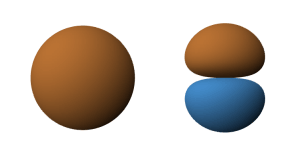
Ryc. 2. Powstawanie hybrydy sp z orbitalu 2s i 2p
Hybryda sp składa się z dwóch pętli. Mianem pętli określa się poszczególne części hybrydy. Jedna z nich jest pozytywna ●, a druga negatywna ●.
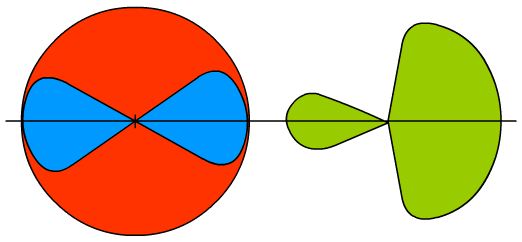
Ryc. 3. Po lewej niezhybrydyzowane orbitale, po lewej graficzna prezentacja hybrydy sp
Pojedyncze hybrydy sp będziemy zapisywać w sposób uproszczony - duża pętla będzie wyglądała jak mała, a małej nie będziemy zaznaczać. Dla odróżnienia hybrydy będą w kolorze zielonym, a orbitale molekularne brązowym. Podstawowe orbitale będą niebieskie lub czerwone.
Hybrydyzacja sp3
W hybrydyzacji sp3 biorą udział trzy orbitale p i jeden orbital s. Można by tu powiedzieć o czymś w stylu zasady zachowania ilości orbitali, czyli tyle ile bierzemy orbitali tyle otrzymujemy pojedynczych hybryd sp. W tym przypadku powstają cztery hybrydy sp. Ten zespół czterech hybryd nazywa się zwyczajowo hybrydą sp3, coś w rzeczywistości są to cztery osobne hybrydy.
Hybrydy zajmują w przestrzeni miejsce zgodnie z teorią VSEPR (→ Chemia nieorganiczna). W tym przypadku są to naroża czworościanu foremnego - tetraedru, dlatego hybrydyzację sp3 nazywamy tetraedryczną. Oprócz hybryd sp widocznych na Ryc. 4 w atomie węgla znajduje się jeszcze niezhybrydyzowany orbital 1s. Wszystkie wiązania, jakie wytworzy atom węgla w tym stanie będą wiązaniami pojedynczymi typu σ. Będzie o tym mowa już niedługo (→ alkany).
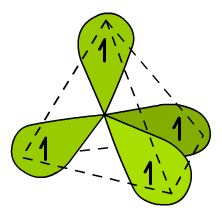
Ryc. 4. Atom węgla w hybrydyzacji sp3
Hybrydyzacja sp2
Tym razem w hybrydyzacji biorą udział dwa orbitale p i jeden orbital s. Skoro hybrydyzują w sumie trzy orbitale to powstają także trzy hybrydy sp. Ustawiają się one w przestrzeni (zgodnie z teorią VSEPR) na płaszczyźnie w narożach trójkąta równobocznego, dlatego hybrydyzację sp2 nazywamy trójkątna płaską (trygonalną).
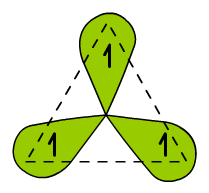
Ryc. 5. Atom węgla w hybrydyzacji sp2
Oprócz hybryd sp widocznych na Ryc. 5 w atomie węgla znajduje się jeszcze niezhybrydyzowany orbital 1s i 2p. Ten ostatni jest prostopadły do płaszczyzny cząsteczki (Ryc. 6) i może tworzyć wiązanie π. Pozostałe wiązania będą wiązaniami typu σ.
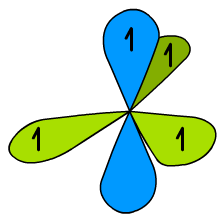
Ryc. 6. Niezhybrydyzowany orbital p w hybrydyzacji sp2
Jeszcze tylko wyjaśnię dla pewności, że na Ryc. 6 widoczne są cztery orbitale. Jeden dwuczęściowy orbital p (niebieski) i trzy połówki hybryd sp (zielone). Nie widać małych pętli hybryd sp oraz orbitalu 1s.
Hybrydyzacja sp
Ostatni typ hybrydyzacji atomu węgla odbywa się pomiędzy dwoma tylko orbitalami (2s i 2p). Tym samym powstają dwie hybrydy sp, które w przestrzeni ustawiają się na linii prostej, dlatego powstają cząsteczki liniowe (a przynajmniej fragment przy Csp jest liniowy).

Ryc. 7. Atom węgla w hybrydyzacji sp
Hybrydy prezentuje Ryc. 7, a dwa niezhybrydyzowane orbitale p przedstawia Ryc. 8. Mogą one wytworzyć dwa wiązania boczne π. Jest to ważne, kiedy przy atomie węgla znajduje się wiązanie potrójne (→ alkiny).
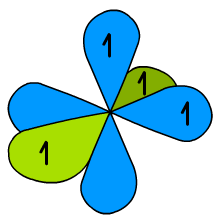
Ryc. 8. Niezhybrydyzowane orbitale p w hybrydyzacji sp
Hybrydyzację sp nazywamy dygonalną. Oczywiste jest, że hybryda jest płaska (do utworzenia czegokolwiek w przestrzeni potrzebne są trzy wymiary).






