Wartościowość
Umiesz już rozpoznawać wzory i nazwy związków chemicznych. Czasem związek ma bardziej skomplikowaną budowę i jest opisywany nazwami zwyczajowymi. Jednak większość związków, z którymi spotkasz się na lekcjach chemii w gimnazjum i liceum to proste związki organiczne i nieorganiczne.
Aby ustalić wzór związków należących do grupy tlenków, wodorotlenków, kwasów i soli często posługujemy się pojęciem wartościowości oraz elektrowartościowości nazywanej zwykle stopniem utlenienia.
Słownik definiuje wartościowość jak następuje:
Wartościowość - liczba wiązań chemicznych, jakie może utworzyć dany atom lub jon z innymi atomami lub jonami.
Myślę, że definicja jest ścisła i przejrzysta, aczkolwiek jak później się przekonasz pojęcie wartościowości ustępuje zwykle stopniom utlenienia.
Pierwiastki grup głównych mają raczej stałe wartościowości:
| Grupa | Wartościowość |
|---|---|
| (1) Litowce | I |
| (2) Berylowce | II |
| (13) Borowce | III |
| (14) Węglowce | IV |
| (15) Azotowce | III |
| (16) Tlenowce | II |
| (17) Fluorowce | I |
| (18) Gazy szlachetne | 0 |
Wartościowości pierwiastków grup reprezentatywnych (głównych 1, 2, 13-18) bez uwzględnienia możliwości koordynacyjnego wiązania się tych atomów i nadbudowywania powłok d
Natomiast pierwiastki grup pobocznych (metale przejściowe) nadają się do charakterystyki jedynie stopniami utlenienia. Dla pewności przeanalizujemy kilka przykładów.
Tlenek żelaza(II). Żelazo ma mieć zgodnie z zaznaczoną w nazwie wartościowością dwa wiązania. Skoro tlen ma zawsze wartościowość równą II można sugerować wzór: FeO z wiązaniem podwójnym. Pamiętajmy jednak, że są to wiązania jonowe.
Tlenek żelaza(III). Tlen ma mieć dwa wiązania, a żelazo trzy. Jedyny sposób to użyć trzech atomów tlenu i dwóch atomów żelaza: Fe2O3. Ryc. 1 przedstawia dlaczego.
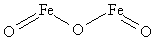
W praktyce ilości atomów wyznaczamy tzw. metodą na krzyż. Oto jak się to robi dla tlenku azotu(I):
- Zapisujemy atomy (zgodnie z zasadami): N O
- Dopisujemy wartościowości: NI OII
- Przepisujemy wartościowości po skosie: NI2 OII1
- Upraszczamy wzór: N2O
Tą samą drogą wyprowadźmy wzór azotku miedzi(II). Przyda się przypomnienie, że azot może wytworzyć tylko trzy wiązania kowalencyjne bądź jonowe, bo posiada trzy niesparowane elektrony i jedną parę elektronową, która może tworzyć wiązania koordynacyjne. W prostych połączeniach metal-niemetal spotykamy wiązanie jonowe, nie koordynacyjne (duża wartość Δχ) i stąd trójwiązalność azotu w tym związku.
- Cu N
- CuII NIII
- CuII3 NIII2
- Cu3N2
Ponownie w punktach poszukajmy wzoru siarczku cyny(IV):
- Sn S
- SnIV SII
- SnIV2 SII4
- SnS2
W ostatnim punkcie mogliśmy podzielić indeksy przez 2. Zawsze jeśli indeksy można podzielić przez jakąś liczbę upraszczając zapis należy to zrobić - analogicznie dla fosforku glinu*:
- Al P
- AlIII PIII
- AlIII3 PIII3
- AlP
*) Jeśli pierwiastek ma tylko jedną wartościowość, lub jeśli nazwa wskazuje na jedyny istniejący związek wartościowości pomija się.
Już nie długo poznasz dokładniej kwasy. Wśród nich kwas siarkowy(VI) - liczba w nawiasie jest stopniem utlenienia, który w tym przypadku pokrywa się z wartościowością atomu centralnego, którym jest siarka. Ryc. 2. przedstawia wzór kwasu siarkowego(VI) z sześcioma wiązaniami przy atomie siarki. Siarka nie spełnia reguły oktetu, ale może sobie na to pozwolić, ponieważ jest ona pierwiastkiem 3 okresu i posiada orbitale d, które mogą przyjmować dodatkowe elektrony. O tym co to są orbitale dowiesz się z tomu Chemia kwantowa.
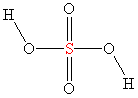
Również całe grupy atomów mogą mieć swoją wartościowość. Np. anion hydroksylowy (OH−) jest jednowartościowy, a anion siarczanowy(VI) (SO42−) jest dwuwartościowy (porównaj z ładunkami jonów). Mając taką wiedzę można ustalać wzory bardziej złożonych soli (o tym będzie dokładniej przy solach). Siarczan(VI) sodu:
- Na (SO4)
- NaI (SO4)II
- NaI2 (SO4)II1
- Na2SO4
Elektrowartościowość w przeciwieństwie do wartościowości bazuje nie na wiązaniach kowalencyjnych, a quasi-jonowych, czyli niekoniecznie istniejących wiązaniach jonowych. O stopniach utlenienia będziemy mówili dokładniej przy omawianiu reakcji redoks oraz w materiale dodatkowym: Stopnie utlenienia.






