Wiązania chemiczne
Mówiliśmy już, że cząsteczka to zbiór połączonych ze sobą atomów. Atomy połączone są ze sobą na różne sposoby. Właśnie teraz postaramy się omówić te połączenia, które będziemy nazywać wiązaniami chemicznymi. Rozważmy różne sposoby połączeń atomów, aby dowiedzieć się, co rządzi chemią wiązań.
Wiązanie kowalencyjne
Wiązania kowalencyjne (atomowe, homopolarne) występują pomiędzy dwoma atomami jednego pierwiastka. Często tworzą cząsteczki homojądrowe, choć nie koniecznie, ponieważ wiązanie O−O w cząsteczce heterojądrowej H2O2 też ma postać czysto kowalencyjną.
Najprostszą sytuacją jest taka, w której spotykają się dwa atomy wodoru. Każdy z nich mając jeden elektron dąży do uzyskania optymalnej konfiguracji. Optymalna konfiguracja to taka, w której występuje największa symetria w rozmieszczeniu elektronów na orbitalach atomowych. Ponieważ wodór jest dość mocno elektroujemny, to będzie dążył do swego celu poprzez przyłączenie elektronu. Skoro jedynym orbitalem wodoru jest orbital 1s, to zechce on przyłączyć jeden elektron aby uzyskać symetryczną parę 1s2. O orbitalach przeczytasz w tomie Chemia kwantowa.
Pierwszy atom będzie tym samym próbował zabrać elektron drugiemu i vice versa. Widzimy, że para elektronowa nie jest tworzona z przyjaźni, tylko przez pazerność obu łączących się atomów. Są one ze sobą tylko dlatego, że jeden i drugi to egoiści, ale żaden nie ma przewagi, czyli na tyle siły by ten elektron zabrać - powstaje wspólna para elektronowa.
Druga sytuacja pojawia się, gdy napotkają się samotne atomy tlenu. Atomy tlenu w momencie, kiedy odrywane są od związków występują "luzem" - taki tlen atomowy nazywamy z łaciny in statu nascendi 'w chwili narodzenia'. Każdy z nich z sześcioma elektronami dąży do uzyskania optymalnej konfiguracji także przez przyłączenie elektronu. Tlen tak jak pozostałe pierwiastki bloku p musi posiadać osiem elektronów na powłoce walencyjnej, aby w pełni ją zapełnić (dwa elektrony na orbital walencyjny typu s i sześć na p). Skoro tlen ma oddać sześć elektronów albo przyłączyć dwa to oczywiście wybiera przyłączanie (jest przecież bardzo elektroujemny). Pierwszy atom tlenu wydziera drugiemu dwa elektrony, drugi zaś pierwszemu także dwa - powstają dwie wspólne pary elektronowe*.
I ostatnia sytuacja ma miejsce np. w przypadku azotu, który to posiada pięć elektronów walencyjnych. Przeprowadzamy rozważania jak w poprzednich przypadkach i dochodzimy do wniosku, że azot do szczęścia potrzebuje jeszcze trzech elektronów. Próbuje wyrwać je od atomu drugiego. Drugi robi to samo z pierwszym pilnując swoich elektronów, aby tamten ich nie zabrał - powstają trzy wspólne pary elektronowe.
*) Opisany jest w tym miejscu tzw. tlen singletowy. Ze względu na specyficzny rozkład elektronów na wiązaniach π cząsteczka tlenu w takim stanie jest nietrwała i przechodzi w tlen trypletowy. Taka cząsteczka staje się dirodnikiem z pojedynczym wiązaniem: •O−O•. Szczegółowy opis znajduje się w materiale dodatkowym: Budowa elektronowa cząsteczki O2.
Wiązanie kowalencyjne spolaryzowane (polarne)
Wiązanie polarne występuje tylko w cząsteczkach heterojądrowych, czyli udział w wiązaniu biorą dwa różne pierwiastki. A skoro tak, to mają różne elektroujemności, czyli z różnymi siłami przyciągają elektrony.
Prosta sytuacja obrazująca taką sytuację to reakcja wodoru z chlorem, na skutek czego powstaje chlorowodór. Wodór posiada jeden elektron i z chęcią przyłączyłby kolejny, chlor posiada aż siedem elektronów walencyjnych. Brakuje mu jednego do szczęścia, a o odłączeniu siedmiu nie ma mowy. W takiej sytuacji mniej elektroujemny wodór musi słuchać się chloru i oddać mu elektron. Nie jest to jednak sytuacja idealna dla jednak mocno elektroujemnego wodoru, więc pomimo tego, że elektron idzie do chloru, to i tak wodór go pilnuje.
Tym samym nie jest to wiązanie jonowe, a tylko uwspólnienie elektronów, gdzie chlor bierze więcej. Powstałe wiązanie jest czymś pośrednim między wiązaniem jonowym, a kowalencyjnym. Powstaje wspólna para elektronowa przesunięta w kierunku atomu o wyższej elektroujemności. Zaznaczanie polaryzacji na wzorze można wykonać na kilka sposobów → Ryc. 1.
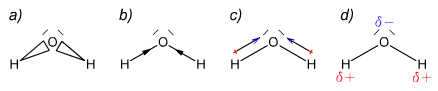
Ryc. 1 Oznaczanie polaryzacji wiązania
Na wzorze c) umieszczone są strzałki, ale posiadają one na jednym z końców (po przeciwnej stronie grota) znak "+". Jest to specjalna strzałka, która służy do oznaczania polaryzacji, ponieważ strzałka zwykła używana jest do oznaczania momentu dipolowego i wiązań koordynacyjnych (choć czasem ta rysowana jest przerywaną linią). O momencie dipolowym będziemy mówić w osobnym rozdziale tego tomu.
Wzór d) z kolei zawiera znaczniki δ+ i δ−. Są to tzw. znaczniki ładunku cząstkowego. Przy atomach δ+ gromadzi się ładunek dodatni, a przy δ− ładunek ujemny.
Wiązanie jonowe (heteropolarne)
Wiązanie jonowe powstaje pomiędzy atomami pierwiastków, gdzie jeden chce oddać, a drugi przyjąć elektron. Do przyłączenia elektronów na powłokę walencyjną dążą niemetale. Metale zaś dążą do oddawania elektronów, czyli są elektrododatnie. W takiej sytuacji, gdy elektroujemny atom chloru poszukujący elektronu spotka atom sodu kombinujący "gdzie by ten jeden elektron z powłoki walencyjnej opchnąć" - dochodzi między nimi do reakcji.
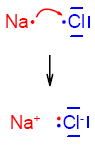
W jej wyniku elektron atomu sodu przemieszcza się na powłokę walencyjną atomu chloru i oba uzyskują trwałe konfiguracje elektronowe. Jednak w wyniku takiej reakcji atom sodu stracił jeden elektron. Skoro elektron posiada ładunek ujemny - tym samym sód uzyskał ładunek dodatni, bo Na0 - e- → Na+. Chlor natomiast wzbogacając się o ten dodatkowy elektron analogicznie uzyskał ładunek ujemny: Cl0 + e- → Cl-. Dwa powstałe jony zaczynają się przyciągać na zasadzie oddziaływania elektromagnetycznego (E-M).
Czyste wiązanie jonowe, w którym elektrony wszystkich atomów w próbce mają zmienione położenie na takie jakie omawialiśmy przed chwilą praktycznie nie istnieje. Nie istnieje także ostra granica pomiędzy wiązaniem kowalencyjnym, kowalencyjnym spolaryzowanym i jonowym. Ogólny schemat relacji pomiędzy tymi wiązaniami można zapisać tak:
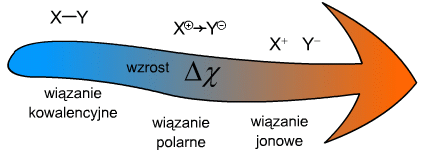
Aby precyzyjnie określać typ wiązania wprowadzono pojęcie: procentowy udział wiązania jonowego (%wj). Na podstawie pomiarów wyznaczono procentowe udziały wiązania jonowego w cząsteczkach, w których atomy posiadają różne różnice elektroujemności, co zestawione zostało na wykresie na Ryc. 4.
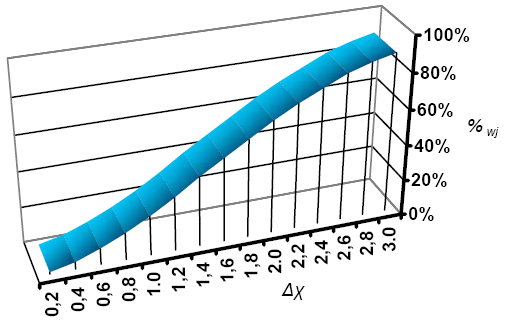
Ryc. 4 Wykres zależności %wj od Δχ.
Zależność jak widać jest dość regularna, dzięki czemu możemy wyznaczać z łatwością %wj na podstawie wartości Δχ. Można to robić na podstawie wykresu, lub można skorzystać z programu Delta-chi. Choć nie jest to funkcja wielomianowa, to można ją przybliżyć za pomocą równania wielomianowego trzeciego stopnia. W najprostszej postaci funkcja taka wyraża się wzorem:
f(x) = −6x3 + 27x2 + x
Funkcja ta jest dość dobra (jak na swoją prostotę) jednak czasem zaniża wyniki, które powinny być takie (zaokrąglone do całości):
| Δχ | %wj |
|---|---|
| 0,0 | 0% |
| 0,1 | 0% |
| 0,2 | 1% |
| 0,3 | 2% |
| 0,4 | 4% |
| 0,5 | 6% |
| 0,6 | 9% |
| Δχ | %wj |
|---|---|
| 0,7 | 12% |
| 0,8 | 15% |
| 0,9 | 18% |
| 1,0 | 22% |
| 1,1 | 26% |
| 1,2 | 30% |
| 1,3 | 34% |
| Δχ | %wj |
|---|---|
| 1,4 | 39% |
| 1,5 | 43% |
| 1,6 | 47% |
| 1,7 | 51% |
| 1,8 | 55% |
| 1,9 | 59% |
| 2,0 | 63% |
| Δχ | %wj |
|---|---|
| 2,1 | 67% |
| 2,2 | 70% |
| 2,3 | 73% |
| 2,4 | 76% |
| 2,5 | 79% |
| 2,6 | 82% |
| 2,7 | 84% |
| Δχ | %wj |
|---|---|
| 2,8 | 86% |
| 2,9 | 88% |
| 3,0 | 89% |
Wiązanie metaliczne
Wiesz już, że dwa atomy niemetalu mogą połączyć się i przy pomocy wiązania o odpowiedniej krotności uwspólnić potrzebną im ilość elektronów. Działa to na zasadzie antagonizmu - próby kradzieży, zabrania elektronu dla siebie. Jest tak dlatego, że niemetale posiadają dużą wartość elektroujemności i dążą do uzyskania oktetu na drodze przyłączania elektronów.
Metale, które jak powiedzieliśmy cechuje elektrododatniość będą wykazywały tendencję do pozbywania się nielicznych elektronów walencyjnych. W sytuacji, kiedy wiele atomów oddaje elektrony, a żaden niemetal ich nie przyjmuje powstaje chmura wolnych elektronów. Atomy pozbawione elektronów walencyjnych tworzą w ten sposób dodatnio naładowane zręby atomowe. Niechciane elektrony stają się niczyje i przemieszczają się dookoła zrębów. Zręby atomowe to jądra i elektrony na tzw. zamkniętych powłokach, czyli niewalencyjnych.
W tym momencie często przytacza się model kawałka metalu. Więc i ja tak zrobię. Prezentuję trójwymiarowy wycinek i płaski przekrój na Ryc. 5.
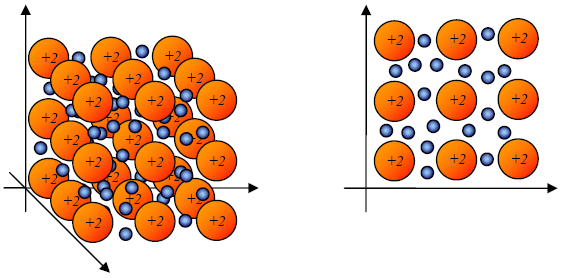
Ryc. 5 Model budowy wewnętrznej metalu (3D i 2D).
Zauważ, że gdy metal tworzy kationy dwudodatnie, to elektronów, które przemieszczają się w próbce jest dwa razy więcej niż zrębów. W glinie, który tworzy jony Al3+ od każdego atomu odłączają się 3 elektrony. Automatycznie elektronów jest wtedy 3 razy więcej niż zębów atomowych. Elektron zawsze posiada ładunek −1 wyrażony w jednostkach ładunku elementarnego (e).
Trójkąt van Arkel-Ketelaara
Trójkąt van Arkel-Ketelaara jest diagramem prezentującym jakie wiązania powstają pomiędzy dwoma atomami o danej elektroujemności. Ryc. 5 ukazuje taki trójkąt.
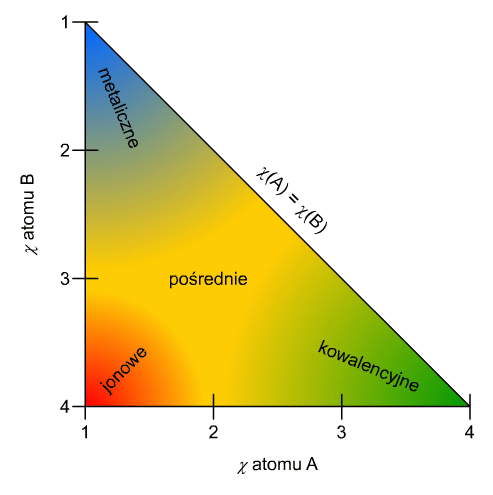
Ryc. 6. Trójkąt van Arkel-Ketelaara
A to dwa linki tematyczne:
Wiązanie koordynacyjne
Często zapominamy o wiązaniach koordynacyjnych nawet w podstawowych wzorach. Przyjęło się, (szczególnie w gimnazjum) oznaczanie wiązania donorowo-akceptorowego się jako wiązanie podwójne. Chemicy organicy używają ładunków formalnych, lecz najwygodniejszy jest chyba zapis tego wiązania za pomocą strzałki od donora do akceptora.
Tak zastanawiamy się nad zapisem wiązania koordynacyjnego, ale może wypada wyjaśnić, co to jest. Najbardziej przemówi w tym momencie przykład. Stwórzmy wzór kwasu azotowego(V) zachowując wszystkie prawidłowości.
Rozpisujemy wszystkie atomy i ich elektrony:
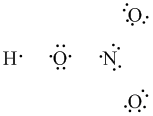
Łączymy "luźne" elektrony kreskami i zliczamy ilość elektronów przy każdym atomie. Pamiętać należy o powstałych parach elektronowych i regule oktetu.
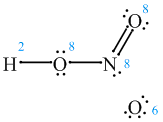
Stąd wynika, że atom azotu, wodoru i dwa z trzech atomów tlenu są "zadowolone", bo osiągnęły oktet, a wodór dublet. Co jednak z pozostałym atomem tlenu? Otóż jak to w kwasach tlenowych często bywa przyłączają się on koordynacyjnie:
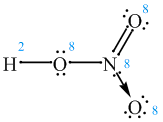
I teraz wszyscy są "zadowoleni". Możliwe, że ostatni wzór wymaga pewnego komentarza. Za pomocą strzałki oznaczyliśmy wiązanie donorowo-akceptorowe, (czyli koordynacyjne). Widać, że polega ono na powstawaniu wspólnej pary elektronowej, ale pochodzi ona od jednego tylko atomu (donor). Przyjmuje tą parę drugi atom (akceptor), który zyskuje w ten sposób oktet elektronowy.
Wydawać by się mogło, że akceptor jest jedyną stroną, która zyskuje na takim wiązaniu. Okazuje się jednak, że pomimo tego, iż azot nie dostaje żadnych elektronów, ani niczego innego, to odciągnięcie pary elektronów na pewną odległość powoduje, że pozostałe cząsteczka zyskuje na trwałości (HNO3 jest znacznie bardziej trwały niż HNO2, który nie posiada koordynacyjnego tlenu).
Wiązanie donorowo-akceptorowe występuje w różnych cząsteczkach. Ich przykłady można znaleźć na Ryc. 10.
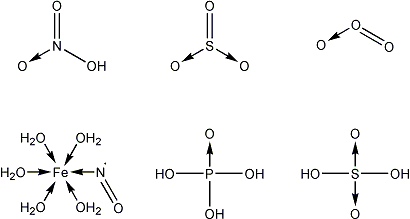
Ryc. 10 Przykłady cząsteczek z wiązaniami donorowo-akceptorowymi
W najprostszym wypadku pierwotnie donor podiada dwa elektrony, a akceptor żadnego, natomiast po utworzeniu wiązania elektrony są wspólne, czyli formalnie każdy z atomów posiada po jednym. Stąd podczas tworzenia wiązania koordynacyjnego dochodzi do formalnego przeniesienia jednego elektronu z donora do akceptora. Wynika z tego faktu możliwość zapisu wiązań koordynacyjnych przy pomocy ładunków formalnych. Trzy różne metody zapisu na przykładzie nitrometanu prezentuje Ryc. 11.
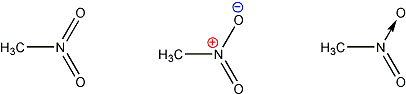
Ryc. 11 Sposób prezentacji wiązań koordynacyjnych (nitrometan).
Wiązanie wodorowe
Bardzo słabe, lecz niezmiernie ważne wiązanie. Wiązania tego typu stabilizują strukturę kwasów nukleinowych i białek. Polega na przyciąganiu jednego protonu przez kilka elektronów. Praktycznie chodzi o to, że jądro atomu wodoru (proton) jest przyciągane przez cząsteczkę, do której należy. Przyciąga je także inna cząsteczka, która zawiera silnie elektroujemny atom z wolną parą elektronową (bardzo często jest to tlen). Przykłady takich cząsteczek można odnaleźć na Ryc. 12.
Wiązanie wodorowe można rozpatrywać jako specyficzny typ wiązania koordynacyjnego w ten sposób, że atom wodoru jest pozbawiany elektronów przez elektroujemny pierwiastek, z którym jest związany (np. tlen czy azot). Tym samym nie ma on teoretycznie elektronów i aby osiągnąć dublet przyłącza parę elektronową innego atomu (który ma wolną parę elektronową). Powstaje takie 'wiązanie semi-koordynacyjne'.
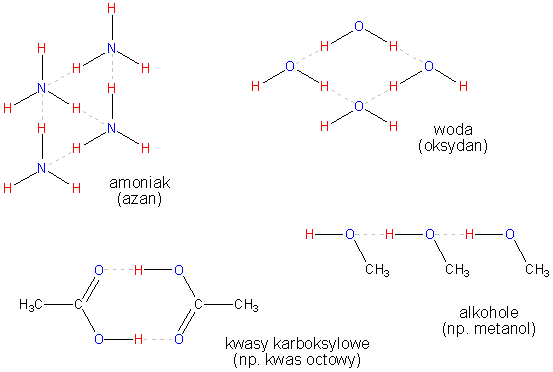
Ryc. 12 Przykłady cząsteczek z wiązaniami wodorowymi.
Układ pierwszy prezentujący asocjację skroplonego amoniaku. Analogicznie zachodzi asocjacja cząsteczek wody. Widać, że są to związki, które mogą tworzyć duże sieci asocjacyjne. Wpływa to na fakt, że amoniak bardzo dobrze rozpuszcza się w wodzie (tworzą się wiązania wodorowe amoniak - woda).
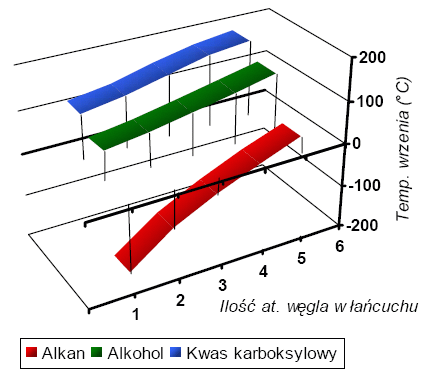
Wzrost temperatury wrzenia u alkoholi i kwasów karboksylowych z tą samą ilością atomów węgla w cząsteczce, co analogiczne alkany, jest spowodowany różnicą w masie oraz istnieniem oddziaływań międzycząsteczkowych. W wypadku alkanów - struktur jednorodnych - brak istnienia niewiążących par elektronowych warunkuje niemożność powstawania wiązań wodorowych. Struktura alkanów jest tym samym swobodna, co powoduje, że są one lotne (czyli o niskiej temperaturze wrzenia, topnienia etc.).
Alkohole posiadają w swoich cząsteczkach tlen, co w podwójny sposób wpływa na temperaturę wrzenia. Po pierwsze dodatkowy atom zwiększa masę cząsteczki i utrudnia wyrwanie jej ze struktury, po drugie umożliwia tworzenie wiązań wodorowych dzięki niewiążącym parom elektronowym tlenu. Cząsteczki alkoholi tworzą wiązania wodorowe formując łańcuch, dlatego połączeniu może ulec dowolna ilość cząsteczek. Utworzenie dużej zwięzłej struktury w znaczący sposób wpływa na zwiększenie temperatury wrzenia.
W wypadku kwasów karboksylowych sytuacja jest nieco inna. Cząsteczki kwasu mogą połączyć się ze sobą w małe grupy za pomocą kilku wiązań wodorowych (nie tworzą zwartej sieci), co powoduje, że ich temperatura nie wzrasta już tak gwałtownie w stosunku do alkoholi, jak alkoholi w stosunku do alkanów. Obserwowany wzrost temperatury wrzenia jest spowodowany wzrostem masy cząsteczkowej związku.
Oddziaływania van der Waalsa
Drugie obok wiązania wodorowego oddziaływania międzycząsteczkowe. Trochę szerszych informacji nt. oddziaływań międzycząsteczkowych znajdziesz w Delcie. Są to wzajemne oddziaływania elektrostatyczne pomiędzy dwoma dipolami lub cząstkami bez momentów dipolowych jako takich. W cząstkach obojętnych oddziaływania van der Waalsa występują na skutek tzw. wyidukowanego momentu dipolowego. Jest to czasowe nierównomierne rozłożenie ładunku elektrycznego. Dlatego cząstki mogą się przyciągać. Oczywiste jest, że jest to oddziaływanie międzycząsteczkowe bardzo słabe (praktycznie najsłabsze) i ma niewielki zasięg - ok. 0,5 nm, czyli 5 Å.
Wiązanie zdelokalizowane
O wiązaniach zdelokalizowanych (jak zresztą o innych) będziemy szczegółowo mówić w tomie Chemia kwantowa, ale na razie można krótko o nich wspomnieć. Są to takie wiązania atomowe, które na skutek oddziaływań między sobą oraz ze względu na sprzyjający kształt cząsteczki nie tworzą się pomiędzy dwoma atomami, ale kilka wiązań spaja się w jedno duże, które nie zajmujące pozycji wiązań pierwotnych, dlatego nazywane jest zdelokalizowanym.
Do najbardziej reprezentatywnych wiązań zdelokalizowanych należy wiązanie w benzenie i jego pochodnych. Elektrony trzech wiązań π tworzą jedno wiązanie (sześć elektronów).
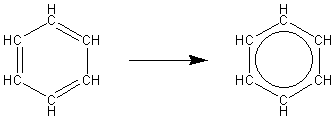
Ryc. 14 Wiązanie zdelokalizowane w cząsteczce benzenu
Pierwszą cząsteczkę nazwalibyśmy raczej: cykloheksa-1,3,5-trien, a druga to "prawdziwy" benzen (tylko rozważania ideologiczne).






