Elektroujemność i elektrododatniość
Trzy najważniejsze dla chemika informacje na temat pierwiastka to jego masa (A), liczba atomowa (Z) i elektroujemność (χ). Pozostałe dane są także ważne, ale już mniej, a często na podstawie jednej lub kilku z przytoczonych danych można wyznaczyć inne.
Grecką literą chi, oznaczono elektroujemność. Mówimy, że elektroujemność to siła, z jaką atom przyciąga do siebie pojedynczy elektron. Ten temat będzie się wiązał z rozważaniami na temat energii jonizacji i powinowactwa elektronowego oraz z teorią wiązań.
Pierwiastki, które silnie przyciągają elektrony, nazwiemy elektroujemnymi. Elektrododatnimi nazwiemy zaś pierwiastki słabo przyciągające elektrony. Należy jednak pamiętać, że elektrododatniość to nie zdolność do odpychania elektronów, ponieważ wszystkie atomy przyciągają własne elektrony.
Elektrododatniość cechuje atomy pierwiastków, które wolą oddawać niż przyłączać elektrony.
Wartość elektroujemności
Powiedzieliśmy, że elektroujemność to zdolność do przyciągania elektronów. Jest ona różna dla różnych atomów, ale dlaczego? Najpierw spójrzmy na problem z dala. Elektroujemnymi nazwiemy pierwiastki silnie przyciągające elektrony, czyli takie, które są zdolne do ich przyjmowania, a to wiąże się z tworzeniem jonów ujemnych (anionów). Aniony tworzą niemetale, dlatego to one są pierwiastkami najbardziej elektroujemnymi. Pierwiastki mniej elektroujemne, zarazem elektrododatnie, będą ulegały pazerności niemetali na elektrony i utworzą jony dodatnie, ponieważ zostaną z nich okradzione. Będą to metale.
Wyznaczanie elektroujemności
Istnieje co najmniej kilka sposobów wyznaczania elektroujemności. Pierwszy z nich podał Linus Pauling (dostał on dwie nagrody Nobla - w dziedzinie chemii i pokojową). Skala, którą opracował jest najbardziej popularna. Nadal nasuwa się pytanie: jak? Pauling przyjął, że fluor ma elektroujemność χF = 4,0, a wodór χH = 2,1. Pozostałe wartości wyznaczył względem tych.
Spróbujmy to zrobić. Prawdą jest, że nie posiadamy żadnych danych doświadczalnych, ale stwórzmy taką "wirtualną tablicę elektroujemności".
Zacznijmy od tego, że musimy znaleźć najbardziej i najmniej elektroujemny pierwiastek - początek i koniec skali. Wiemy, że elektroujemność rośnie wraz z charakterem niemetalicznym (im pierwiastek jest bardziej niemetaliczny tym ma większą elektroujemność). Najbardziej niemetaliczny jest pierwiastek, który najmocniej trzyma własne elektrony, czyli taki, który posiada najmniej powłok (wtedy wszystkie elektrony są blisko jądra) i jak najmniejszy promień. Wiemy, że promienie atomów maleją zgodnie z ich masą, ponieważ rośnie ładunek jądra. I już! Najbardziej elektroujemny jest pierwiastek na samym końcu (po prawej) układu okresowego, (bo tam są one cięższe niż w tym samym okresie, a po lewej) oraz na samej jego górze, ponieważ tam pierwiastki w danej grupie posiadają najmniej powłok elektronowych. Teraz już konkretnie - jest to... hel.
Wielu chemików zabiłoby mnie za ten wniosek. Już się prostuję. Wiemy, że elektroujemność to siła, z jaką atom przyciąga elektrony podczas wiązania się z innymi pierwiastkami, a przecież hel się z niczym nie wiąże - jest gazem szlachetnym o idealnej konfiguracji. W takiej sytuacji określenie elektroujemności helu (i innych gazów szlachetnych*) jest nie możliwe, a przynajmniej irracjonalne.
*) Znane są nieliczne związki gazów szlachetnych
Najbliższym stosownym pierwiastkiem (takim, który wiąże się w związki) o najwyższej elektroujemności będzie tym samym fluor.
Najbardziej elektrododatnim będzie pierwiastek najlżejszy (z lewej strony) i o największej liczbie powłok (na dole). Wynika z tego, że pierwiastkiem o najsilniejszym charakterze metalicznym jest frans, czyli ma on najmniejszą elektroujemność.
Znaleźliśmy początek i koniec naszej skali - teraz musimy wszystkie pierwiastki ułożyć wg wzrastającej elektroujemności i przypisać im wartości pośrednie. Masa bardziej wpływa na elektroujemność niż odległość powłoki walencyjnej i dlatego rozkład elektroujemności, choć ma pewne ukierunkowanie, to jest dość nieregularny. Rozkład ten prezentuje Ryc. 1.
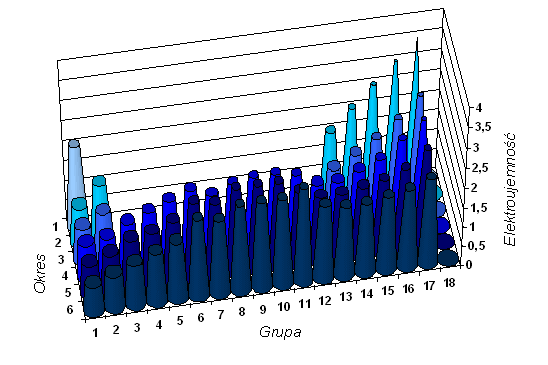
Ryc. 1. Rozkład wartości elektroujemności
Dlaczego elektroujemność jest dla nas ważna?
Pozwala ona dość precyzyjnie określić rodzaj wiązania jakie występuje pomiędzy dwoma atomami. Do tego celu korzysta się z różnicy elektroujemności pierwiastków (Δχ - litera chi nie znajduje się w indeksie - to jej naturalny wygląd) i wyznacza tzw. procentowy udział wiązania jonowego (%wj). Stosując interaktywny wykres wykreślony empirycznie (na podstawie doświadczeń) można odczytać, jaki jest udział wiązania jonowego dla zadanej różnicy elektroujemności. Program z wykresem, (DeltaChi) wchodzi w skład pakietu CHX, gdzie można go ściągnąć.
Mówimy, że gdy Δχ = 0, to wiązanie jest czysto kowalencyjne, a w innym wypadku udział procentowy wiązania jonowego wynosi ileś tam (wiązanie spolaryzowane). Gdy udział wiązania jonowego przekracza 50% można uznać wiązanie za jonowe. Przedstawiają to przybliżenia:
Wiązanie uznajemy za kowalencyjne ⇔ Δχ ∈ (0; 0,4) ⇔ %wj ∈ (0%; 5%)
Wiązanie uznajemy za polarne ⇔ Δχ ∈ (0,4; 1,7) ⇔ %wj ∈ (5%; 50%)
Wiązanie uznajemy za jonowe ⇔ Δχ ∈ (1,7; +∞) ⇔ %wj ∈ (50%; 100%)
W tym momencie odwołuję do rozdziału poświęconego wiązaniom.






