Układ okresowy pierwiastków
Z grubsza wyróżniamy kilka typów układów okresowych. Pierwszy z nich, który powstał najwcześniej to tzw. tablica Mendelejewa. Dziś nazywana krótką formą układu okresowego. Istnieje forma długa, która jest najpopularniejsza i dobrze wszystkim znana. Jej prawidłowa nazwa to tablica Wernera. Istnieje wiele ciekawych układów kolistych, spiralnych, trójwymiarowych, w kształcie galaktyki i jeszcze inne. Poniżej zamieszczam odnośniki do kilku nietypowych układów okresowych:
- http://umbbd.ahc.umn.edu/periodic/images/spiral18.gif
- http://www.petcom.com/~john/periodictable.jpg
- http://www.metanature.org/graphics/spiralinner.jpg
- http://www.metanature.org/graphics/spirileight.jpg
- http://www.metanature.org/graphics/spiralfull.jpg
- http://chemlab.pc.maricopa.edu/periodic/images/stowetable.gif
- http://chemlab.pc.maricopa.edu/periodic/images/spiral.gif
- http://chemlab.pc.maricopa.edu/periodic/images/triangle.gif
- http://chemlab.pc.maricopa.edu/periodic/images/tarantola.gif
- http://chemlab.pc.maricopa.edu/periodic/
- http://www.periodicspiral.com/
Kiedyś stworzyłem nawet własną formę układu w celu szybkiej obserwacji konfiguracji elektronowych. Jeśli ktoś oglądał tom Chemia kwantowa, z pewnością zauważy analogię do graficznej konfiguracji. Taki typ układu bardzo mocno oddaje zależności rozmieszczenia elektronów, co powoduje, że pojęcie bloków energetycznych w tablicy Wernera zaczyna nabierać sensu. Układ pokazuje Ryc. 1.

Ryc. 1. Układ konfiguracyjny
W tym rozdziale interesować nas będzie tablica Mendelejewa i Wernera, czyli krótka i długa forma układu okresowego. Pomimo, że mówiliśmy o tak egzotycznych typach układów, dla wielu osób zwykła tablica Mendelejewa jest czymś kosmicznym. Z nazwy wszystko wydaje się ok. Jak się powie "tablica Mendelejewa", to każdy niby wie, o co chodzi, ale gdy pokaże mu się prawdziwą tablicę tego naukowca nasz respondent wybałusza oczy i nie wie, z czym to się je.
Cała rzecz polega na tym, że to, co zwykły zjadacz chleba uznaje za tablicę Mendelejewa jest w rzeczywistości tablicą Wernera, a oryginalną tablicę rosyjskiego uczonego widział mało kto.
Tablica Mendelejewa
W 1817 roku J. W. Döbereiner układał symbole w triady pierwiastków o podobnych właściwościach, ale nie maiło to jednak nic wspólnego z dzisiejszym układem okresowym. Dopiero około 1869 roku Dmitrij Iwanowicz Mendelejew (Дмитрий Иванович Менделеев), aby położyć kres zakuwaniu właściwości pierwiastków na blaszkę, tak jak to robili wszyscy chemicy do tej pory, postanowił uporządkować pierwiastki w logiczny sposób. Uszeregował znane mu pierwiastki według wzrastającej masy atomowej:
H, Li, Be, B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Br, Rb, Sr, Y, Zr, Nb, Mo, Ru, Rh, Pd, Ag, Cd, In, Sn, Sb, Te, I.
Następnie spostrzegł, że co ósmy pierwiastek posiada podobne właściwości. Pierwiastki o podobnych właściwościach umieszczał pod sobą:
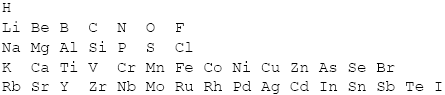
Wodór nie pasował, ale Mendelejew wiedział, że wodór jest dziwny. Kolejne dwie kolumny pasowały idealnie, ale dalej... Wiedział, że fluor, chlor, brom i jod muszą się znajdować w jednej kolumnie, ponieważ mają zbliżone właściwości. Zrobił tak:
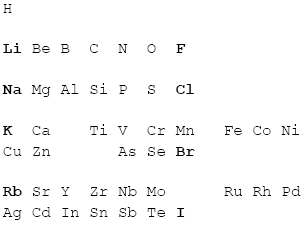
Dzięki takiemu zabiegowi zarówno lekkie metale takie jak lit, sód, potas i rubid jak i podobne do siebie fluor, chlor, brom i jod znajdowały się w odpowiednich kolumnach. Mendelejew zauważył dziury. Postanowił wypełnić je teoretycznymi pierwiastkami, (które miał nadzieję odkryć) oraz podać ich właściwości na podstawie właściwości sąsiadów.
W ten sposób Mendelejew opisał właściwości eka-boru, eka-glinu (eka-aluminium), eka-krzemu, eka-manganu i kilku innych pierwiastków.
W 1875 roku odkryto gal - nowy pierwiastek, który umieszczono w miejscu eka-glinu. Odpowiadał on właściwościom przewidzianym przez rosyjskiego uczonego:
Według Mendelejewa eka-glin powinien mieć masę atomową 68u, zaś w rzeczywistości wyniosła ona 69,5u. W gęstości pomylił się o 0,1 g/cm3. Prawidłowo ustalił wzory tlenku i chlorku oraz kilka innych właściwości.
Układ Mendelejewa funkcjonował dość długo jako podstawowa forma układu okresowego oparta na prawie okresowości. Z czasem, przybywało pierwiastków, tablica rosła i wszyscy byli zadowoleni, że można w niej z łatwością umieścić każdy pierwiastek. Niestety do czasu.
Tablica Wernera
Choć hel teoretycznie odkryty został około 1868 roku, to faktycznie jego wyizolowanie przypisuje się Sir Williamowi Ramsayowi i datuje na rok 1895. Wtedy to właśnie powstał problem natury technicznej - gdzie umieścić hel w tablicy Mendelejewa? Jego masa wskazywałaby, że pomiędzy wodorem, a litem, ale tam uczony nie przewidywał już żadnych nowych pierwiastków.
Z czasem okazało się, że potrzebne jest znacznie więcej miejsc w układzie, których nie przewidział Mendelejew. Konkretnie pomiędzy wodorem a litem dla helu, fluorem a sodem dla neonu, chlorem a potasem dla argonu itd... Łatwo można zauważyć, że po prostu pomiędzy metalami lekkimi, a fluorowcami brakuje jednej kolumny dla gazów, o podobnych właściwościach, które ze względu na bierność (małą reaktywność) chemiczną nazwano szlachetnymi.
Dodatkowa grupa, którą umieszczano albo jako pierwszą, albo ostatnią mocno nadwerężyła ufność chemików do tablicy Mendelejewa. Wtedy to powstał pomysł stworzenia nowej tablicy nazwanej tablicą Wernera. Była to długa forma układu okresowego - taka, jaką najczęściej widujesz.
W 1905 A. Werner opracował nowy rewolucyjny układ okresowy. Bardziej czytelny niż wszystkie inne. Znalazł w nim miejsce dla pierwiastków z VIII grupy Mendelejewa, (które wystawały za układ) oraz dla gazów szlachetnych.
W tablicy Wernera pierwiastki ułożone są zgodnie ze wzrastającym ładunkiem jądra (liczba Z) i podzielone na okresy tak, aby właściwości pierwiastków były w grupach podobne.
Okazuje się, że ilość pierwiastków w danym okresie można opisać wzorem:
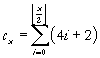
Przy czym wyrażenie to można uprościć opuszczając znak sumy. Powstaje wtedy następujący ciąg: cx = 2(⌊x/2⌋ + 1)2. Wzór ten wskazuje fakt, iż właściwości są cechą periodyczną - powtarzającą się co pewien okres (okresu występowania właściwości nie należy mylić z okresami układu okresowego). Okres powtarzania się właściwości jest zmienny (Mendelejew twierdził, że wynosi on osiem, ale nie miał do końca racji). Opisuje go podany wcześniej wzór. Początkowo (dla wodoru i helu wynosi dwa potem dla dwóch kolejnych okresów osiem (tu wartość wskazana przez Mendelejewa) następnie osiemnaście aż w końcu trzydzieści dwa dla dwóch ostatnich okresów. Warto wspomnieć, że ilość okresów w układzie jest nieskończona, mówiąc o ostatnim okresie mówimy o ostatnim znanym okresie. W kolejnym ósmym okresie będziemy mogli umieścić aż pięćdziesiąt nowych pierwiastków.
Budowa układu okresowego
Ponieważ na dzień dzisiejszy niewiele osób korzysta z tablicy Mendelejewa, zrezygnujemy z dalszego jej opisu, bo byłaby to sztuka dla sztuki. Zajmiemy się natomiast tablicą Wernera i poszukamy związków pomiędzy układem, a właściwościami pierwiastków.
Pomimo, że sama tablica Wernera ma głębszy sens chemiczny, to często będziemy używać skrótów typu lewa strona układu, górny prawy róg etc.
Układ okresowy w najbardziej podstawowej formie można zilustrować, jako tabelę z symbolami pierwiastków rozłożonymi w konkretny sposób. Jednak najczęściej układ zawiera wiele innych informacji takich jak: nazwa, masa (liczba A), liczba atomowa (Z), elektroujemność, rzadziej można znaleźć informacje takie jak konfiguracja elektronowa, czy stopnie utlenienia. Kolor tła komórki, w której znajduje się symbol często ma znaczenie i może wyrażać przynależność pierwiastka do pewnej grupy. W ten sposób można dokonać podziału na metale, półmetale, niemetale (czasem też wyróżnia się osobno gazy szlachetne).
Istnieją także układy tematyczne, w których można znaleźć wzory tlenków, temperatury wrzenia i topnienia, izotopy, sieci krystaliczne, datę odkrycia i wiele, wiele innych właściwości.
Tak, jak każda tabela układ okresowy można podzielić na kolumny i wiersze. Mają one jednak specjalne nazwy. Kolumnę nazwiemy grupą, zaś wiersz okresem. Tablica Wernera w formie standardowej zawiera 18 grup, (choć może być ich więcej lub mniej - w zależności od potrzeby) i 7 okresów. Układ o większej ilości grup niż 18 widać na Ryc. 1 w poprzednim rozdziale.
Okazuje się, że okres informuje nas o tym, ile powłok posiada atom danego pierwiastka. Grupa, z grubsza, informuje o ilości elektronów walencyjnych. Kolejne okresy są coraz szersze, a kolejne bloki energetyczne wciskają się we wcześniejsze, dlatego układ ma kształt wygryzionego prostokąta.
To, o czym trzeba na początek wiedzieć to zachowanie się niektórych właściwości:
Liczba A i Z zwiększają się w prawo i w dół. Promienie atomowe zwiększają się w lewo i w dół. Elektroujemność rośnie w prawo i w górę. Reaktywność maleje im bliżej środka układu (Ag, Au, Pt).
Dodatkowo przez cały czas w treści innych rozdziałów będziemy mówić o zależnościach panujących w układzie, a dotyczących omawianego tematu.






