Metale, półmetale, niemetale
Czym różni się metal od niemetalu i dlaczego istnieją półmetale? Na to pytanie spróbujemy odpowiedzieć w tym rozdziale. Aby uzyskać odpowiedź konieczne jest posiadanie pewnej wiedzy na temat budowy atomu i jego własności.
Atom składa się z dodatnio naładowanego jądra i elektronów, które znajdują się (niekoniecznie krążą po orbitach) w przestrzeni, którą nazywamy wokółjądrową. Wiadomo nam, że aby atom pierwiastka był stabilny musi osiągnąć idealną konfigurację elektronową. Konfiguracja elektronowa to sposób rozmieszczenia elektronów w przestrzeni wokółjądrowej. Przez pojęcie idealna konfiguracja rozumiemy konfigurację gazu szlachetnego. O tym, dlaczego gaz szlachetny ma konfigurację idealną, można dowiedzieć się w tomie Chemia kwantowa. Chodzi o symetryczne rozmieszczenie elektronów na orbitalach powłoki walencyjnej.
O właściwościach pierwiastka takich jak jego wartościowość, charakter metaliczno-niemetaliczny i wielu innych decyduje ilość najbardziej oddalonych od jądra elektronów. Są to tzw. elektrony walencyjne. Często mówi się (szczególnie w gimnazjum), że są to elektrony na ostatniej powłoce, którą nazywa się walencyjną. Poznanie struktury elektronowej w późniejszych latach nauki pozwala zrozumieć, że nie koniecznie musi to być prawda. Konkretnie elektrony walencyjne są to elektrony ostatniej (zewnętrznej) powłoki elektronowej (tzw. walencyjnej) i ostatnich (zewnętrznych) podpowłok d i f, o ile istnieją. Jeśli jednak nie wiesz, co to są podpowłoki s, p, d czy f - nie martw się. Wystarczy, że będziesz wiedzieć, iż elektrony walencyjne pierwiastków grup reprezentatywnych (grupy 1, 2 i 13 do 18) leżą właśnie na ostatniej powłoce.
Na Ryc. 1 przedstawiam podział pierwiastków na bloki w układzie okresowym. Pomimo, że wiele układów zalicza hel do bloku p - hel należy do bloku s! Widoczny układ jest nieco wirtualny, bo nie znamy pierwiastków okresu 8 i 9, a tym samym żadnych pierwiastków bloku g, który został drastycznie okrojony.
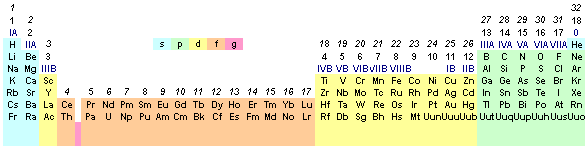
Ryc. 1. Podział układu okresowego na bloki
Ale nie o tym mowa. Podział na bloki jest o tyle ważny, żeby rozumieć, co mam na myśli mówiąc np. pierwiastki bloku d (te na żółto). Walencja (łac. valentia) pierwiastków bloku s równa się numerowi grupy IUPAC, pierwiastków bloku p równa jest numerowi grupy IUPAC pomniejszonej o 10, a dla pierwiastków bloku d i f jest bardzo mocno zróżnicowana i wiąże się z maksymalnym stopniem utlenienia.
Promieniem atomu nazywamy odległość ostatniej powłoki od jądra. Logiczne jest, że wraz ze wzrostem ilości powłok elektronowych wzrasta promień atomu. Wraz ze wzrostem liczby atomowej wzrasta ładunek jądra, elektrony są mocniej przyciągane i tym samym promień atomu się zmniejsza.
Atomy o małym promieniu atomowym mocno trzymają swoje elektrony, ponieważ znajdują się one blisko jądra, zaś atomy o dużym promieniu mogą oddawać elektrony ze względu na to, iż są one stosunkowo luźno związane. Cały czas mówimy oczywiście o elektronach walencyjnych, bo tylko takie mogą być oddawane i tylko na powłokę walencyjną pierwiastek może przyjąć elektron.
Przyłączanie i odrywanie elektronów ma na celu osiągnięcie konfiguracji elektronowej gazu szlachetnego, o której już wspominaliśmy.
Pierwiastki z niewielką ilością elektronów walencyjnych, słabo je trzymające, czyli z względnie dużymi promieniami atomowymi nazwano metalami dużo wcześniej niż było wiadomo, dlaczego nimi są. Metale mają skłonność do oddawania elektronów w celu osiągnięcia konfiguracji elektronowej najbliższego gazu szlachetnego.
Oddając elektrony metale będą tworzyć jony dodatnie nazywane kationami. Atom metalu może tworzyć jony nawet pięciododatnie (np. Sb5+) jednak większość jonów to jony jedno-, dwu- i trójdodatnie. Może się pojawić pytanie. Dlaczego dodatnie? Wynika to z prostego rozumowania: skoro elektron jest jednoujemny, to X0 - e- → 0 - (-1) = +1 → X+. Powstaje jon dodatni. Zauważ, że we wzorach pomijamy liczbę 1.
Teraz zastanówmy się, czy metale są elektroujemne, czy elektrododatnie. Jeśli elektroujemność to zdolność do przyciągania elektronów, a elektrododatniość to zdolność do ich oddawania, to metale są elektrododatnie.
Ale nie wszystkie atomy pierwiastków muszą mieć duże promienie atomowe. Istnieją jeszcze takie pierwiastki, które mocno trzymają swoje elektrony, bo mają małe promienie atomowe. Te elektroujemne pierwiastki będą dążyć do uzyskania idealnej konfiguracji gazu szlachetnego poprzez przyłączanie elektronów na powłokę walencyjną. Przyłączenie elektronu będzie wiązać się tym razem z utworzeniem jonu ujemnego - anionu. Jedno-atomowe aniony zazwyczaj są jedno-, dwu- lub trójujemne. Pierwiastki je tworzące nazwano niemetalami.
Jednak metal metalowi nie równy. Mówimy, że elektrododatnie metale oddają elektrony, ale jedne robią to chętniej, a inne mniej chętnie. Miarę tych chęci można nazwać reaktywnością. Im bardziej atom chętny do oddania elektronu tym bardziej reaktywny. Energia potrzebna do oderwania elektronu od atomu i odsunięcia do na dużą (∞) odległość nazywana jest energią jonizacji. O ile oderwanie jednego elektronu jest stosunkowo proste, to odrywanie kolejnych wiąże się z koniecznością wkładu coraz większej energii, ponieważ nie zabiera się elektronów z obojętnego atomu tylko kationu, który przyciąga mocniej elektrony. Z tego względu wyróżnia się pierwszą, drugą, trzecią i dalsze energie jonizacji. Oznaczamy Ej1, Ej2, Ej3 itd. i wyrażamy w elektronowoltach na atom (eV / atom ) lub (eV ⋅ mol-1).
Niemetal niemetalowi także nie równy. Siła, z jaką przyciąga elektron jest zależna od wartości jego elektroujemności. Im większa elektroujemność (mniejszy promień), tym atom mocniej przyciąga elektrony i tym samym jest bardziej reaktywny. Energia wydzielana podczas przyłączenia elektronu nosi nazwę powinowactwa elektronowego (Ep).
Obserwujemy na podstawie dwóch poprzednich akapitów, że reaktywność pierwiastków wzrasta w kierunku zarówno lewego dolnego rogu jak i prawego górnego rogu układu okresowego. Jednak reaktywność metali jest inna od reaktywności niemetali. Z tego względu wprowadzono pojęcie charakteru metalicznego i charakteru niemetalicznego. Charakter metaliczny wzrasta wraz z reaktywnością metali, a spada ze wzrostem aktywności niemetali. Charakter niemetaliczny zachowuje się odwrotnie. Analogicznie wraz ze wzrostem charakteru metalicznego wzrasta reaktywność metali, a przy wzroście charakteru niemetalicznego coraz bardziej reaktywne są niemetale.
Zauważmy teraz, że skoro charakter niemetaliczny rośnie w prawo, to pierwiastki na lewo będą metalami, a im bardziej w prawo (i do góry) tym bardziej będą niemetaliczne. Możemy powiedzieć, że charakter metaliczny niemetali jest bardzo mały, ale musimy pamiętać, że jakiś tam jednak jest. Z tego powodu nie istnieje sztywna granica pomiędzy metalami i niemetalami. Niemetale też są troszkę metaliczne, a metale niemetaliczne, dlatego granica jest płynna. W miejscu, gdzie stosunek charakteru metalicznego do niemetalicznego jest bliski jedynce pojawiają się pierwiastki o obojnaczych właściwościach mogące zarówno przyjmować jak i oddawać elektrony, ale skoro oba charaktery są małe to pierwiastki te są mało reaktywne. Pierwiastki takie nazwano półmetalami, do których należy np. krzem czy antymon.
Zauważ, że w pobliżu półmetali znajdują się też metale szlachetne - to nie przypadek. Pamiętasz chyba, że środek układu to miejsce mało reaktywnych pierwiastków.






