Pierwiastki
Zapewne wiesz, co to jest pierwiastek. Jednak chodzi nie tylko o to, aby wiedzieć, że są metale i niemetale i jakie mają nazwy. Prawdziwy chemik zawsze pyta, dlaczego? W tym rozdziale odpowiemy sobie na wiele drobnych pytań, które często pojawiają się podczas nauki chemii, a dotyczą właśnie pierwiastków.
Mimo wszystko wypada rozpocząć od definicji pierwiastka:
Pierwiastek chemiczny to zbiór atomów o tej samej liczbie atomowej Z, czyli o jednakowej ilości protonów. Atomy danego pierwiastka mogą się różnić liczbą neutronów tworząc izotopy o różnych masach oraz ilością elektronów tworząc jony o różnych ładunkach (dodatnich - kationy i ujemnych - aniony).
Dawniej nie istniała tak ścisła definicja...

Ryc. 1. Rekonstrukcja tekstu z: Jan Wolski - Fizyka stosownie do teraźniéyszego stanu wiadomości krótko zebrana, Warszawa, 1817.
Niektóre pierwiastki chemiczne mogą występować w tzw. odmianach alotropowych. Są to homojądrowe (zawierające w sobie atomy tylko jednego pierwiastka, gdy w skład cząsteczki wchodzi kilka pierwiastków, to cząsteczkę nazwiemy heterojądrową) cząsteczki o różnej ilości i połączeniu atomów danego pierwiastka. Przykładami mogą być odmiany alotropowe węgla: grafit, diament, fuleren, czy tlenu: tlen O2, ozon O3 oraz nowo odkryty tlen O4. Swoje odmiany posiadają też pierwiastki takie jak arsen, cyna, fosfor, antymon, selen, czy siarka. Odpowiednia zmiana kondycji (temperatura, ciśnienie) powoduje przejście z jednej odmiany alotropowej w inną, co nazywamy przemianą alotropową.
Mówiliśmy już o tym, że przemiany jednych pierwiastków w inne mogą zachodzić samorzutnie tylko w przypadku pierwiastków radioaktywnych, czyli promieniotwórczych. Można jednak sztucznie zmieniać pierwiastki jedne w drugie na skutek bombardowania ich jąder wysokoenergetycznymi cząstkami. Mogą to być protony, znane Ci cząstki α i inne.
Pierwiastki możemy podzielić na metale, półmetale i niemetale. Podział ten powstał już dawno, ponieważ różnice w ich właściwościach są drastycznie różne. Jednak dopiero wiele lat później udowodniono, czym tak naprawdę różni się metal od niemetalu i dlaczego istnieją półmetale. Często wyróżnia się też grupę nazywaną gazami szlachetnymi. Są to gazy bierne chemicznie z ostatniej (18 lub 0) grupy układu okresowego.
Wierzymy, że w całym Wszechświecie występują takie same pierwiastki, jak na Ziemi, z tym że większość Wszechświata stanowi wodór w stanie wolnym (ponad 90%), a resztę pozostałe pierwiastki. Dla porównania wodór w skorupie ziemskiej stanowi 0,14% masowego.
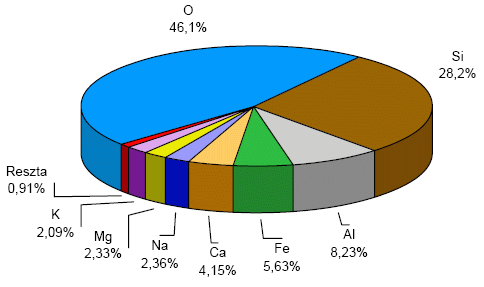
Ryc. 2. Zawartość procentowa pierwiastków w skorupie ziemskiej
Na Ziemi większość pierwiastków występuje w związkach chemicznych. Ich zawartość procentową (% masowy) w skorupie ziemskiej prezentuje Ryc. 2. Obserwujemy pewną prawidłowość. Im pierwiastek cięższy tym jest go w przyrodzie mniej. Wiąże się to głównie z dwoma aspektami. Primo pierwiastki ciężkie są coraz bardziej promieniotwórcze, dlatego w pewnym momencie ze (wzrostem liczby atomowej) pierwiastki są tak nietrwałe, że nie występują w przyrodzie. Są to wszystkie pierwiastki o liczbie atomowej większej od 83, które raczej otrzymujemy sztucznie. Secundo na początku, gdy jeszcze nie istniały atomy, a właśnie się tworzyły powstawał wodór, dopiero połączenie dwóch atomów wodoru dało hel. Takie procesy zachodzą cały czas m.in. na naszym słońcu. Później dopiero powstawały pierwiastki cięższe takie jak Li, Be, B, C, N, O, F. Dlatego wśród nich znajdziemy większość tzw. pierwiastków życia, czyli tych, które występują w największych ilościach w naszych organizmach. Jeszcze cięższe pierwiastki powstały dużo później.
Ilość znanych pierwiastków ciągle wzrasta. Pierwiastki nie są jednak już odkrywane jak kiedyś, tylko wytwarzane sztucznie - na drodze reakcji jądrowych, których mechanizmy poznałeś. Pierwiastków występujących w przyrodzie znamy 90 (to już nie ulegnie zmianie) kolejne zostały otrzymane sztucznie. Na rok 2005 znamy wszystkie pierwiastki od 1H do 111Rg oraz jeszcze nienazwane pierwiastki 112Uub, 114Uuq, 116Uuh i 118Uuo; z tym, że odkrycie tego ostatniego zostało zakwestionowane. Ogromne trudności przysparza nam wytworzenie pierwiastka o liczbie protonów 113.
Z powodu nagłego przyrostu ilości pierwiastków zaczęto oprócz nazw wprowadzać symbole. Na początku były to symbole graficzne - wprowadzone przez Johna Daltona [dʒɔn daltɔn] (patrz Ryc. 3).

Ryc. 3. Zestawienie symboli wprowadzonych przez Daltona
Ryc. 4. Przykładowe cząsteczki (modele wg Daltona)
Po pewnym czasie pierwiastków było tak dużo, że i one nie zdawały egzaminu. W 1815 roku Jöns Jacob von Berzelius [dʒɔns dʒejkɔb fɔn bəziljəs] wprowadził stosowaną po dziś dzień symbolikę literową. Symbole tworzone były od pierwszej litery nazwy łacińskiej pierwiastka. W wypadku, gdy dwa pierwiastki zaczynają się na tę samą literę stosowano kolejne litery, dla niektórych pierwiastków o liczbach atomowych ponad 100 stosuje się trzyliterowe oznaczenia tymczasowe. Zestawienie nazw i symboli znajduje się na prawie każdym układzie okresowym.






