Promieniotwórczość
Większość pierwiastków chemicznych występuje w postaci kilku typów atomów, różniących się między sobą liczbą neutronów w jądrze. Wyróżniamy np. trzy typy atomów wodoru, pięć typów atomów węgla oraz 16 typów atomów ołowiu. Te różne typy atomów jednego i tego samego pierwiastka nazywane są izotopami (gr. isos 'równy', topos 'miejsce'), ponieważ zajmują one to samo miejsce w układzie okresowym pierwiastków. Wszystkie izotopy danego pierwiastka mają taką samą liczbę protonów, lecz różnią się liczbą neutronów w jądrze. Atom pierwiastka opisany liczbami A i Z nazywamy nuklidem.
Substancje zawierające tzw. izotopy ciężkie np. 2H (wodór ciężki - deuter) w miejsce 1H mają większą masę, co można wykryć za pomocą spektrometru masowego (→ Techniki chemiczne). Przykładem może być tzw. ciężka woda (2H2O lub D2O).
Jądra atomowe niektórych izotopów (tzw. radioaktywnych) ulegają samoistnym przemianom w jądra innych izotopów lub pierwiastków w celu osiągnięcia trwałości. Aby to osiągnąć wypromieniowują one rozmaite cząstki i fale elektromagnetyczne.
Cząstki emitowane z jąder w trakcie rozpadu promieniotwórczego tworzą promieniowanie jądrowe uwalniane na zewnątrz. Wyróżniamy trzy podstawowe naturalne przemiany jądrowe: α, β i γ.
Należałoby się zastanowić nad tym, dlaczego izotopy bywają radioaktywne. Otóż jak powiedziałem atom emituje cząstki w celu osiągnięcia trwałości. Nasuwa się szybko wniosek, że pierwiastki radioaktywne są nietrwałe, ale co o tym decyduje? Wiemy, że w skład jądra wchodzą protony, które się odpychają oraz stabilizujące je neutrony. Jednak duży nadmiar neutronów destabilizuje jądro. Dlatego prot i deuter są trwałe, zaś tryt - nie.
Wartością charakteryzującą trwałość może być stosunek ilości neutronów do ilości protonów w jądrze. Można tę wartość oznaczyć n/p lub N/Z. Z tym że to drugie oznaczenie jest stosowane częściej. Zatem najtrwalsze powinny być izotopy, których jądra zawierają tyle protonów, co neutronów (N/Z = 1). Nie jest to jednak święta prawda.
Owszem, co do lekkich pierwiastków to mniej więcej tak jest, jednak ciężkie pierwiastki potrzebują coraz większego nadmiaru neutronów, aby utrzymać protony razem.
Promieniowanie β−
W sytuacji, kiedy nadmiar neutronów jest za duży jądra stają się nietrwałe. Aby osiągnąć stabilność jądro będzie musiało się pozbyć neutronu. Oczywiście można by wypromieniować neutron, ale są rozwiązania korzystniejsze energetycznie. Wyrzucanie neutronów → promieniowanie α. Przyjrzyj się następującemu zapisowi:
n0 → p+ + e− + νe
p+ → n0 + e+ + νe
Wynika z niego, że neutron może rozpaść się na proton, elektron i antyneutrino elektronowe, zaś proton na neutron, pozyton (dodatni elektron, czyli antyelektron) i neutrino elektronowe. Wiedzę na temat takich przemian można posiąść po przestudiowaniu tomu Chemia kwantowa (Model standardowy).
Dowiedzieliśmy się, że neutron może rozpaść się na proton. To właśnie jest idealne rozwiązanie dla jądra, bo nie dość, że traci neutron to zyskuje proton. Produktami ubocznymi są elektron i antyneutrino elektronowe. Zajmiemy się tylko elektronem, który uwalniając się z jądra wraz z innymi wypromieniowanymi elektronami tworzy strumień promieniowania, który został nazwany β−.
Skoro liczba N/Z charakteryzuje stałość jądra to można by pokusić się o wykres zależności N od Z. Na podstawie tej wartości można ocenić także typ promieniowania. Wykres taki możesz zobaczyć na Ryc. 1. Oznaczono na nim emitery α, β− i β+.
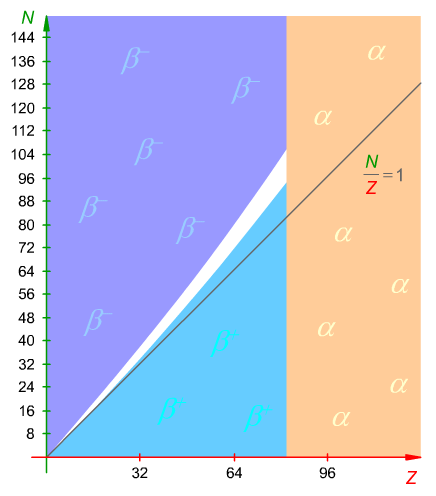
Ryc. 1. Trwałość jąder atomowych, a stosunek N/Z. Oznaczono emitery α, β− i β+. Kolor biały - jądra trwałe.
Odczytując informacje ze schematu z pewnością zauważasz następujące rzeczy: im izotop cięższy tym w jądrze większy ładunek i większa ilość neutronów potrzebna do jego stabilizacji. Lekkie, trwałe izotopy stosunek N/Z mają bliski 1 (szara linia). Nadmiar neutronów lekkich izotopów objawia się promieniowaniem β−, zaś ich niedomiar promieniowaniem β+. Cięższe izotopy zawsze α-promieniują.
Aby łatwo zapamiętać, kiedy izotop jest promieniotwórczy, można przyjąć, że pierwiastki o liczbie Z większej niż 83 zawsze są promieniotwórcze, a dla lekkich pierwiastków obowiązuje zasada:
N/Z ≅ 1 - stabilny
N/Z > 1 - niestabilny
N/Z > 1.3 - promieniotwórczy
Promieniowanie β+
Jest to promieniowanie podobne do β− jednak "odwrotne" w skutkach. Ma miejsce przy nadmiarze protonów w stosunku do neutronów.
Wiesz już, że proton może się rozpaść na neutron, pozyton i neutrino elektronowe. Taki proces zachodzi właśnie podczas promieniowania β+. Jego skutkiem jest utrata protonu, pozyskanie neutronu oraz wydzielanie strumienia pozytonów (e+) nazywanego promieniowaniem β+.
Promieniowanie α
Cięższe pierwiastki, których liczba protonów w jądrze przekracza 83, czyli od 84Po wzwyż praktycznie zawsze są promieniotwórcze. Żaden nadmiar neutronów, który nie spowodowałby rozpadu β− nie jest w stanie ustabilizować jądra. W takiej sytuacji jądro pozbywa się zarówno protonów jak i neutronów przechodząc w lżejszy pierwiastek.
Aby uzyskać zamierzony celi niemożliwe są połączone ze sobą rozpady β− i β+, ponieważ znoszą się one, co można udowodnić nawet na papierze:
n0 → p+ + e− + νe
p+ → n0 + e+ + νe
Podstawiamy:
n0 → n0 + e+ + νe + e− + νe
Neutrony się skracają. Pozostałe elektron i antyelektron (pozyton) oraz neutrino i antyneutrino elektronowe ulegają anihilacji:
e+ + e− + νe + νe → 0
W skutek zachodzących naraz procesów rozpadu β− i β+ nic by się nie zmieniło, dlatego jądro w takiej sytuacji zmuszone jest do wypromieniowania innych cząstek. Są one identyczne z jądrami helu, czyli 24He2+. Skutkiem tego rozpadu (oprócz przemiany jądra) jest strumień cząstek 24He2+ (zwanych cząstkami α), który nazywany promieniowaniem α.
Promieniowanie γ
Ponieważ rozpad α oraz oba rozpady β prowadzą do wzbudzonego stanu konfiguracji elektronowej, to aby przejść ze stanu wzbudzonego na mniej wzbudzony, lub podstawowy atom musi pozbyć się nadmiaru energii. W tym celu emituje on kwant energii, w postaci fali elektromagnetycznej (hν), co nazywamy promieniowaniem γ właśnie. Jest to kolejny typ promieniowania jądrowego, który towarzyszy prawie wszystkim pozostałym procesom promieniotwórczym.
Charakterystyka różnych promieni
| Nazwa | Elementy składowe | Siła jonizacji | Zasięg | Ładunek i oddziaływania | Szkodliwość |
|---|---|---|---|---|---|
| α | Jądra helu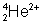 |
20.000 par jonów/cm |
Kilka cm | Cząstki dodatnie, oddziałują z polem ujemnym |
Bardzo szkodliwe, mało skuteczne |
| β− | Elektrony e- |
1.000 par jonów/cm |
Około 1 m | Cząstki ujemne, oddziałują z polem dodatnim |
Szkodliwe, skuteczne |
| β+ | Pozytony e+ |
1.000 par jonów/cm |
Około 1 m | Cząstki dodatnie, oddziałują z polem ujemnym |
Szkodliwe, skuteczne |
| γ | Kwanty energii hν |
1 para jonów/cm |
Wiele m | Promieniowanie obojętne, nie oddziałuje z polami |
Szkodliwe w dużych dawkach |
Charakterystyka różnego rodzaju promieniowania
Reguła przesunięć Soddy'ego-Fajansa
Reguła przesunięć Soddy'ego-Fajansa mówi o tym, jak zmieni się liczba masowa i atomowa (A i Z) na skutek emisji różnego rodzaju promieniowania. Regułę można interpretować równaniami ogólnymi:
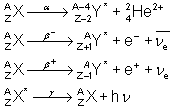
Właściwie nie jest to coś, co powinno kogoś zadziwić. Nie trzeba pamiętać żadnych reguł, tylko znać dobrze zachodzące procesy, aby pisać takie równania.
Innym sposobem jest interpretacja reguły Soddy'ego-Fajansa na płaszczyźnie (Ryc. 4).
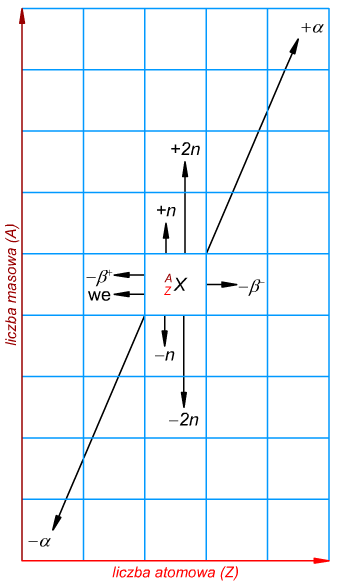
Ryc. 4. Reguła przesunięć Soddy'ego-Fajansa
Legenda do strzałek:
+α - wychwyt cząstki α
−α - emisja cząstki α
−β− - emisja cząstki e− z rozpadu neutronu
−β+ - emisja cząstki e+ z rozpadu protonu
+n, −n, +2n, −2n - wychwyty i emisje neutronów (jednego lub dwóch)
we - wychwyt elektronu z orbitalu 1s (tzw. wychwyt K)
Szeregi promieniotwórcze
Bardzo często w przyrodzie procesy promieniotwórcze zachodzą w pewnym określonym porządku. Serie sekwencyjnych przemian promieniotwórczych α i β (mowa oczywiście o rozpadzie β−) prowadzących do powstania izotopu stabilnego (trwałego) nazywamy szeregiem promieniotwórczym. Wyróżniamy cztery ważne szeregi promieniotwórcze:
- Uranowy
- Torowy
- Aktynowy
- Neptunowy
Graficzną prezentację tych czterech szeregów promieniotwórczych można znaleźć na Ryc. 5, Ryc. 6, Ryc. 7 i Ryc. 8.
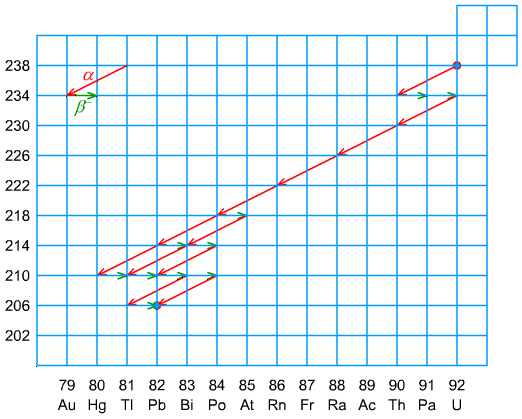
Ryc. 5. Szereg uranowy
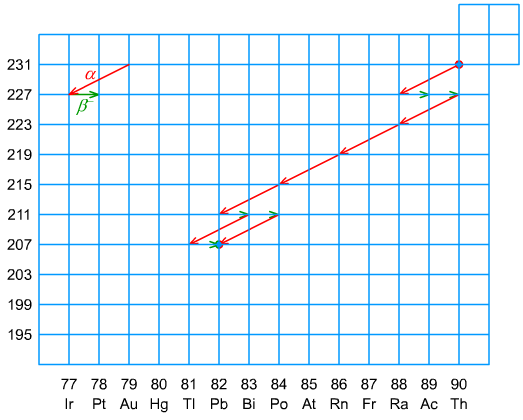
Ryc. 6. Szereg torowy
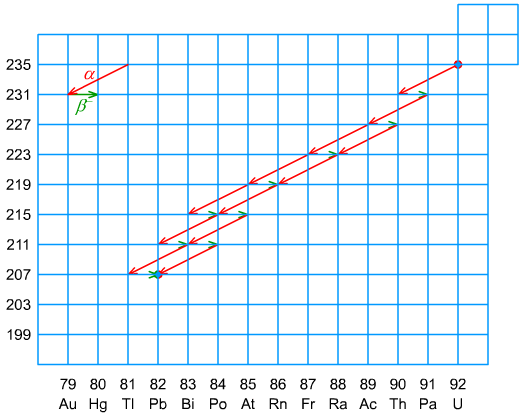
Ryc. 7. Szereg aktynowy
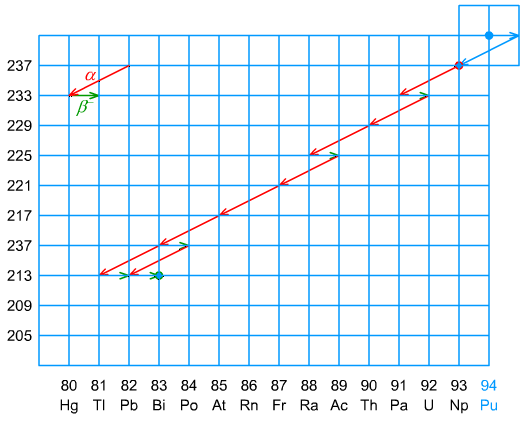
Ryc. 8. Szereg neptunowy
Szereg uranowy, torowy i aktynowy - występują w środowisku naturalnym. Ponieważ czas połowicznego zaniku 235U jest stosunkowo krótki - τ½ (235U) = 713 ⋅ 106 y, porównując do τ½ (238U) = 4,49 ⋅ 109 y i τ½ (232Th) = 13,9 ⋅ 109 y, nuklidy szeregu aktynowego występują w ilościach śladowych.
Czwarty szereg - neptunowy - występował przez 2,2 mln lat istnienia Ziemi i w tym czasie wszystkie jego nuklidy przeszły w izotopy trwałe. Jednak, na skutek skażeń promieniotwórczych izotopem 241Pu, pojawił się ten szereg ponownie. 241Pu rozpada się na 241Am, a następnie 237Np, co zostało oznaczone niebieskimi strzałkami na szeregu neptunowym, a rozpoczyna wspomniany szereg.






