Pojęcie atomu
Około IV w. p.n.e. w starożytnej Grecji pojawiło się pojęcie atomu. Grecki filozof - Demokryt z Abdery (ok. 460 - 370 p.n.e.) wraz ze swym nauczycielem sformułowali filozofię atomizmu. Głosiła ona, że wszystko składa się z atomów, które poruszają się w próżni:
Naprawdę istnieją tylko atomy i próżnia, reszta jest opinią. Próżnia jest konieczna, by ruch był możliwy.
Była to oczywiście tylko teoria, pogląd filozoficzny. Za jego życia nie było jeszcze nauki. Wykształciła się ona później jako odłam filozofii. Pierwsza była fizyka (gr. phýsis 'natura'). Chemia jako nauka wykształciła się około XVII w. z alchemii, którą zajmowano się od XI w. Jednak dopiero w 1808 r. John Dalton opracował teorię atomistyczno-cząsteczkowej budowy materii:
Atomy mają kształt kuli; wszystkie atomy tego samego pierwiastka są identyczne*; atom jest najmniejszą cząstką pierwiastka, która posiada wszystkie jego cechy; atomy łączą się tworząc cząsteczki; zbiór takich samych cząsteczek to związek chemiczny; atomy są najmniejszymi elementami, z których zbudowana jest materia**.
*) dopiero później odkryto izotopy - i Ty
dowiesz się o nich później
**) tu się mylił
Dziś wiemy, że atomy są podzielne. Wiemy nawet, że cząstki, które później nazwano elementarnymi (gdyż przypuszczano, że te się nie dzielą), z których zbudowany jest atom też są podzielne. Mamy już duże doświadczenie w odkrywaniu coraz to mniejszych cząstek materii, więc dziś już chyba nikt nie odpowie, jaka jest ta najmniejsza.
Jak udowodniono podzielność atomu?
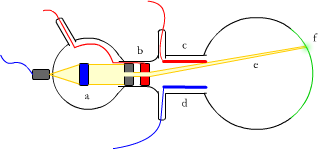
Ryc. 1. Lampa katodowa: (a) katoda, (b) anoda, (c) dodatnio naładowana płytka kondensatora, (d) ujemnie naładowana płytka kondensatora, (e) promienie katodowe, (f) ekran pokryty siarczkiem cynku
W 1897 roku Ferdinand Braun stworzył, specjalną lampę (lampa katodowa) - taką, jaką widzisz na Ryc. 1. Posiadała ona dwie elektrody zatopione w specjalnie wydmuchanej bańce, w której powietrze było mocno rozrzedzone (żeby nie powiedzieć, że panowała tam próżnia). Do elektrod przykładano duże napięcie (różnicę potencjałów). Na ekran w lampie próżniowej kierowano przypuszczalnie jakiś strumień promieni i oto, co się okazało: na ekranie pokrytym siarczkiem cynku pojawiał się świetlisty punkt. Był to dowód na istnienie promieni, które nazwano katodowymi.
Później eksperymentowano dalej. Okazało się, że gdy promieniowanie katodowe przechodzi pomiędzy okładkami kondensatora, (panuje między nimi pewna różnica potencjałów), to promienie odchylają się w kierunku elektrody dodatniej, co można było zaobserwować na ekranie. Udowodniono w ten sposób, że nowe promienie pochodzące "z wnętrza atomu" posiadają ładunek ujemny. Udowodniono też, że cząstki promieniowania posiadają masę umieszczając na drodze promieni wiatraczek (Ryc. 2). Okazało się, że wiatraczek zaczyna się obracać, dlaczego?
Tu trochę fizyki: wiatraczek może się obracać tylko zgodnie z prawem zachowania pędu. Mówi ono, że suma pędów przed zderzeniem i po nim jest równa w układzie izolowanym, a takim z pewnością była próżniowa bańka szklana. Skoro wiatraczek posiada swoją masę, (bo tego jesteśmy pewni) i zaczyna się obracać, to znaczy, że wzrasta jego pęd. Dzieje się tak, gdy promienie katodowe przekazują mu swój pęd. A skoro pęd to iloczyn masy i prędkości (p = m⋅v) i promieniowanie katodowe posiada zarówno pęd jak i prędkość - oznacza, że nie może mieć zerowej masy.
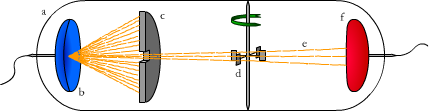
Ryc. 2. Obracanie wiatraczka promieniami katodowymi: (a) szklana rurka, (b) katoda, (c) przesłona, (d) wiatraczek, (e) promienie katodowe, (f) anoda
Elektrony
W 1896 roku J. Thomson wyznaczył stosunek ładunku do masy w promieniowaniu katodowym, stwierdzając przy tym, że stosunek ten jest niezależny od rodzaju metalu, jaki został użyty do wykonania elektrody. Cząstki promieniowania katodowego nazwano elektronami. R. Millikan jako pierwszy wyznaczył dość dokładną wartość ładunku i masy elektronu. Dziś wiemy, że:
e = 1,602 176 53⋅10-19 C
me = 9,109 382 6⋅10-31 kg
Thomson zaproponował model atomu, który nazwał "rodzynki w cieście" (Ryc. 3), ponieważ wyobrażał sobie elektrony jako ujemnie naładowane cząstki zatopione w dodatnio naładowanym atomie.
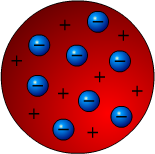
Ryc. 3. Atom - rodzynki w cieście
Przyjęto umownie, że elementy naładowane dodatnio oznacza się kolorem czerwonym, ujemnie niebieskim, a obojętne szarym lub zielonym.
Elektrony były tym samym pierwszymi poznanymi składnikami atomu. Następnie Wilhelm Konrad Roentgen [rœntgen] odkrył promienie X. Promienie te powstawały na tzw. antykatodzie. Antykatoda to płytka z pewnego materiału, która jest umieszczona na drodze promieni katodowych. Antykatodę można zobaczyć na schematycznym rysunku prezentującym doświadczenie Moseleya (Ryc. 4).
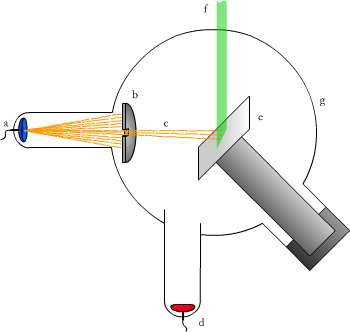
Ryc. 4. Doświadczenie Moseleya: (a) katoda, (b) przesłona, (c) strumień elektronów (promienie β−), (d) anoda, (e) antykatoda, (f) strumień promieni X, (g) szklana bańka z rozrzedzonym powietrzem
Roentgen udowodnił, że promienie X to promieniowanie jonizujące powietrze. W tym celu naelektryzował on elektroskop i skierował na niego promienie X. Elektroskop się zdeelektryzował. Oznaczało to tyle, że promienie X mogły jonizować powietrze, które zabierało ładunek z elektroskopu. Było to też promieniowanie, które nie odchylało się w okładkach kondensatora, dlatego stwierdzono, że nie posiada ono ładunku.
Nad promieniami Roentgena zaczął pracować H. Becquerel [beqerel]. Poszukiwał on związku, jaki mógł istnieć pomiędzy promieniami Roentgena, a luminescencją soli uranu. W toku swoich badań odkrył on kolejne promieniowanie, które nazwał uranowym (promieniowanie Becquerela).
Badaniem tych z kolei promieni zajęła się M. Skłodowska-Curie z mężem oraz E. Rutherford [raðəfəd]. Maria Curie odkryła dwa nowe pierwiastki, którym nadała nazwy: polon (na cześć Polski - to Nasz pierwiastek) oraz rad. Oprócz nowych pierwiastków Maria Curie wysunęła hipotezę, że w atomach pewnych pierwiastków promieniowanie powstaje samoistnie. Taki proces określiła mianem radioaktywności naturalnej.
Ernest Rutherford zajął się badaniem promieniowania jądrowego. Wykazał on, że promieniowanie pochodzące od radu, który odkryła Curie odchylało się w okładkach kondensatora w stronę okładki naładowanej ujemnie, więc samo miało ładunek dodatni. Rutherford zaobserwował, że to promieniowanie posiada jeszcze mniejszy zasięg niż poznane wcześniej promieniowanie katodowe, a i to nie posiadało dużego zasięgu. Ten rodzaj nazwano promieniowaniem α. Inne promieniowanie atomowe odchylało się w stronę dodatnio naładowanej okładki kondensatora w identyczny sposób jak poznane promieniowanie katodowe. Stwierdzono tym samym, że jest to strumień elektronów i nazwano promieniowaniem β. Dziś oznaczamy ten typ promieniowania symbolem β−, ponieważ znamy jeszcze jeden typ promieniowania β (β+). Tym zajmiemy się jednak w rozdziale poświęconym promieniowaniu.
Zauważono jeszcze występowanie trzeciego rodzaju promieniowania, które praktycznie zawsze towarzyszyło promieniowaniu α i β. Nie odchylało się ono pomiędzy okładkami kondensatora, więc stwierdzono, że jest to promieniowanie elektromagnetyczne - tak jak promieniowanie rentgenowskie. W dalszych badaniach dowiedziono jednak, że ten rodzaj promieniowania znacznie silniej przenika przez przeszkody (nie nadawało się np. do wykonywania zdjęć rentgenowskich). Było to promieniowanie o mniejszej długości fali (λ) niż promienie X. Nazwano je promieniowaniem γ.
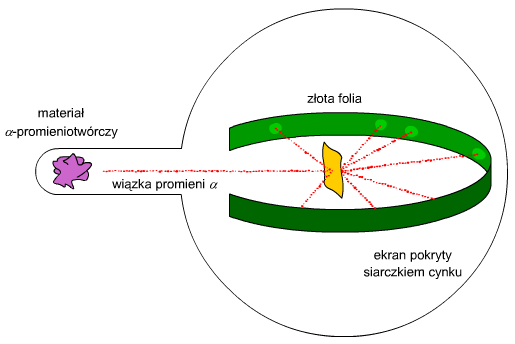
Ryc. 5. Doświadczenie Rutherforda
Później Louis Victor de Broglie [də bʁœj] wysunął hipotezę, że w pewnych warunkach elektron zachowuje się jak fala, zaś w innych jak cząstka. W ten sposób powstała teoria korpuskularno-falowej natury elektronu. Korpuskularny (łc. corpus 'ciało') - cząsteczkowy.
Protony
Już coraz krótsza droga dzieli nas od odkrycia protonów. Ernest Rutherford wykonał doświadczenie, którego schemat przedstawia Ryc. 5, a którego interaktywną wersję znajdziesz w dziale download, pod hasłem doświadczenie Rutherforda. Chodziło o to, że bombardował on cienką złotą folię cząstkami α. Można było spodziewać się trojakiego wyniku doświadczenia: cząstki odbiją się, przelecą przez folię lub zostaną przez nią zaadsorbowane. Wynik był jednak zupełnie inny. Część cząstek odbiła się (i to pod różnymi kątami), a część przeleciała prze folię zmieniając swoje tory ruchu. Miejsca, w które trafiały cząstki α obserwował Rutherford na ekranie pokrytym siarczkiem cynku (ZnSO4); była to obręcz. Przykładowy wynik takiego doświadczenia prezentuję na Ryc. 6.

Ryc. 6. Rozwinięta obręcz z doświadczenia Rutherforda
Rutherford wyciągnął następujące wnioski: skoro większość cząstek α przeleciała przez folię bez problemu, ale było też sporo takich, które gwałtownie zmieniły tor ruchu - staje się jasne, że dodatni ładunek, od którego odbijały się cząstki α nie mógł być rozprowadzony równomiernie po całym atomie (jak twierdził Thomson), tylko musi on być zgromadzony w centrum atomu. W dodatku musi stanowić niewielki procent jego objętości, bo większość cząstek przeleciała bez gwałtownej zmiany toru ruchu. To centralne miejsce atomu, w którym zgromadzone były ładunki dodatnie nazwał Rutherford jądrem. Wyciągając dalsze wnioski zaproponował w 1911 roku planetarny model atomu, który przedstawię później.
Wiadomo było, że jądra zawierają cząstki naładowane dodatnio. Nazwano je protonami i ustalono, że ilość ładunków dodatnich jest równa liczbie porządkowej (Z). Liczba ta zyskała nową nazwę: liczba atomowa. Cząstki, które tworzyły jądro, a posiadające ładunek o jednakowej wartości, zaś przeciwnym znaku jak elektrony nazwano protonami.
Neutrony
Cały czas zastanawiano się, w jaki sposób protony w jądrze mogą trzymać się razem nie odpychając się wzajemnie. Stwierdzono, że muszą istnieć jakieś cząstki o zerowym ładunku, które stabilizują jądro separując protony. Nazwano je neutronami jeszcze zanim zostały odkryte.
Z ich odkryciem uczeni mieli najwięcej problemów, ponieważ neutrony nie posiadały ładunku (promieniowanie neutronowe nie było jonizujące). W próbach udowodnienia istnienia tych cząstek nie ustawano. Z pomocą znowu przyszło promieniowanie α.
W. Bothe i H. Becker bombardowali cząstkami α płytki z metali lekkich wybijając z nich pewne cząstki. Promienie te nie miały właściwości jonizujących i ciężko było je rejestrować.
Ciekawe doświadczenie przeprowadziła Irena Joliot-Curie [ʒɔljɔ kiri] (córka Marii) wraz ze swym mężem. Umieścili oni na drodze nowego promieniowania przenikliwego płytę z parafiny, która jest związkiem organicznym, a te z kolei bogate są w wodór. Nieznane cząstki wybijały z parafiny jądra wodoru (protony), które można było rejestrować przy użyciu elektroskopu.
W 1932 roku J. Chadwick [tʃadwik] przypominając sobie wyniki doświadczeń i zasadę zachowania pędu (mx ⋅ vx + mp ⋅ vp = mx ⋅ vx' + mp ⋅ vp') rozumował następująco: skoro początkowo protony mają zerową prędkość, i nieznane cząstki po zderzeniu je wybijają, zaś same się zatrzymują, bo vx = vp', to:
mx ⋅ vx + mp ⋅ 0 = mx ⋅ 0 + mp ⋅ vp'
mx ⋅ vx = mp ⋅ vp'
vx = vp'
mx ⋅ vp' = mp ⋅ vp'
mx = mp
Tym samym udowodnił, że masa nieznanych cząstek jest równa masie protonów, a ich ładunek jest zerowy (zrobił to na papierze). Zostało udowodnione istnienie neutronów.
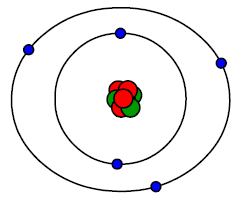
Ryc. 7. Atom - model Rutherforda
Ostateczny planetarny model atomu opracowany przez Ernesta Rutherforda prezentuje Ryc. 7.
Współczesny model atomu
Dzisiejsze wyobrażenia, co do wyglądu atomu są nieco inne. Uwaga! tekst może sprawiać niektórym problemy i zdecydowanie wykracza za program gimnazjum i liceum.
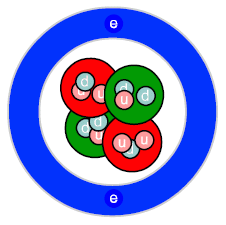
Ryc. 8. Atom - model współczesny
Twierdzimy, że elektrony (cząstki elementarne - niepodzielne) nieustannie poruszają się wokoło jądra, ale nie koniecznie po kołowych orbitach. Same elektrony często uznajemy za rozmyte chmury ładunku ujemnego. Opisujemy je wtedy jako stany kwantowe funkcjami falowymi (→ Chemia kwantowa). Na Ryc. 8 widać sferyczny orbital 1s atomu helu z dwoma stanami kwantowymi (1s2) - jeden porusza się (nie koniecznie kręci) w jednym, drugi w przeciwnym kierunku. Jądro składa się z protonów i neutronów, które nie są (jak kiedyś twierdzono) cząstkami elementarnymi. Składają się one z kwarków dwóch typów: górnego (u) i dolnego (d). Proton to trzy kwarki: uud, zaś neutron: udd. Kwarki w obrębie protonu lub neutronu oddziałują na siebie silnie (→ oddziaływanie silne) wymieniając się gluonami - powstaje pole sił kolorowych, dlatego protony i neutrony są bardzo trwałe i ciężko spowodować ich rozpad. Protony mogą także wymieniać się gluonami z neutronami - powstaje resztkowe pole sił kolorowych, które, pomimo że słabsze od normalnego pola sił kolorowych, to przeciwdziała odpychaniu elektromagnetycznemu protonów stabilizując w ten sposób jądro. Wszystkie te zagadnienia opisuje tzw. Model standardowy.
Nuklidy
Atom opisujemy za pomocą różnych liczb w następujący sposób:
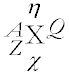
| X | Symbol pierwiastka |
| A | Liczba masowa |
| Z | Liczba atomowa |
| Q | Ładunek elektryczny |
| η | Stopień utlenienia |
| χ | Elektroujemność |
Atom opisany konkretnymi liczbami nazywany jest nuklidem.






