Alkeny
Alkeny są związkami organicznymi zaliczanymi w przeciwieństwie do alkanów do węglowodorów nienasyconych. Cechą charakterystyczną związków nienasyconych jest występowanie w ich cząsteczkach wiązań π. Wiązania π zawsze towarzyszą wiązaniom σ i dlatego związki nienasycone muszą zawierać wiązania podwójne lub potrójne. Tego typu wiązania nazywamy wielokrotnymi.
Wszystkie związki nienasycone zawierają wiązania π w postaci wiązań wielokrotnych (podwójnych lub potrójnych).
Alkeny jako charakterystyczną posiadają w nazwie zamiast -an końcówkę -en. Zamiast etanu jest eten, a zamiast nonanu nonen, itd.
Eten
Alkeny są węglowodorami, które zawierają przynajmniej jedno wiązanie podwójne. Alkeny zawierające dwa wiązania podwójne nazywamy dienami, trzy trienami, a zawierające ich wiele polienami.
Przyjżyjmy się bliżej budowie orbitalnej etenu (dawniej eten nazywano etylenem). Jest on najprostszym przedstawicielem alkenów. Nie ma metenu, ponieważ nie mogłoby być w nim wiązania wielokrotnego.
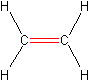
Atomy węgla w cząsteczce H2C=CH2 są w hybrydyzacji sp2, czyli cząsteczka przybiera kształt płaski. Kąty pomiędzy wiązaniami wynoszą 120°. Ryc. 2 prezentuje MO cząsteczki etenu. Widać cztery wiązania C−H typu czołowego σsp-s, jedno wiązanie C−C typu σsp-sp i drugie wiązanie C−C, jednak tym razem typu πp-p. Tworzy się ono z niezhybrydyzowanych orbitali p.
Orbitale p nie będące w stanie hybrydyzacji są domeną hybrydyzacji sp2 i sp. W pierwszej jest jeden niezhybrydyzowany orbital p, a w sp są dwa.
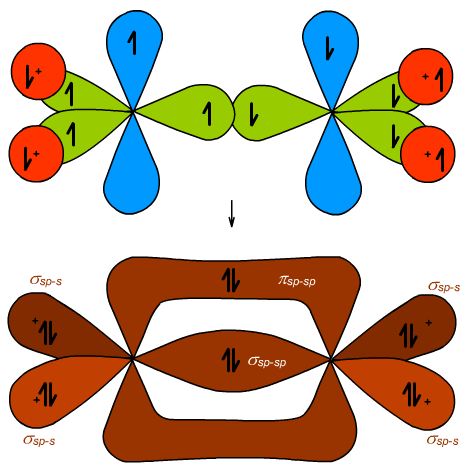
Ryc. 2. Orbitale etenu (etylenu)
Grupa winylowa
Po oderwaniu od etenu jednego atomu wodoru otrzymujemy alkil postaci:
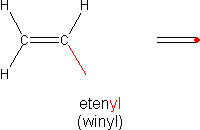
Alkil ten nazywamy grupą winylową H2C=CH•. Bardziej systematyczna nazwa to winyl, a najlepsza etenyl (jednak praktycznie nie używana).
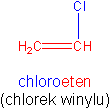
Ważnym związkiem winylowym jest chloroeten (chlorek winylu). Jest on monomerem poli(chlorku winylu), dlatego wrócimy do niego przy polimeryzacji.
Szereg homologiczny alkenów
| Nazwa | Wzór strukturalny | Wzór sumaryczny |
|---|---|---|
| eten | 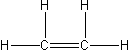 |
C2H4 |
| propen | 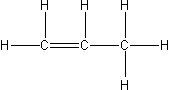 |
C3H6 |
| but-1-en | 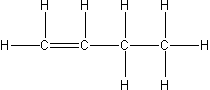 |
C4H8 |
| pent-1-en | 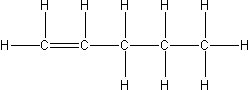 |
C5H10 |
Ogólnie wzór strukturalny n-alk-1-enów można zapisać jako:
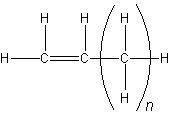
Dla etenu n = 0, dla propenu n = 1, itd... Sumarycznie alkeny mają dwukrotnie więcej atomów wodoru niż węgla, co zapisać można we wzorze sumarycznym: CnH2n.
Wykonajmy charakterystykę alkenów...
Struktura alkenów:
- Posiadają wiązanie podwójne (π) - grupa winylowa
- Przy wiązaniu podwójnym tworzą płaskie struktury
- W miejscach nasyconych tworzą rozbudowane przestrzennie łańcuchy proste lub rozgałęzione
- Atomy węgla przybierają hybrydyzację trygonalną sp2
- Występuje rotacja dookoła wiązań C−C
- Brak rotacji dookoła wiązania C=C (izomeria geometryczna)
- Różna ilość grup metylenowych −CH2−
Właściwości fizyczne alkenów:
- Hydrofoby (są niepolarne), reagują z wodą
- Rozpuszczalne w rozpuszczalnikach niepolarnych (np. alkanach)
- Ze wzrostem ilości atomów węgla t.top. ↑, t.wrz. ↑, gęstość ↑, aktywność ↓
- Są łatwopalne
Właściwości chemiczne alkenów:
- Ulegają reakcjom spalania
- Ulegają reakcjom przyłączenia (addycji) do wiązania podwójnego
- Ulegają reakcjom polimeryzacji
- Są reaktywne
- Wykazują izomerię geometryczną trans-cis
Otrzymywanie
Alkeny otrzymać można na kilka sposobów. Wszystkie sprowadzają się jednak do reakcji eliminacji dwóch podstawników przy wiązaniu pojedynczym. Jednego z jednej strony, drugiego z drugiej. Ogólnie można przedstawić ten proces tak, jak na Ryc. 10.
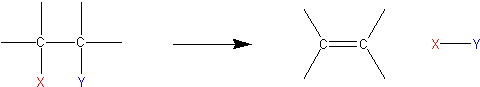
Tak więc dla etenu mogą to być:
Dehydrogenacja etanu:
H3C−CH3 p, T, k→ H2C=CH2 + H2
Dehydratacja etanolu:
H3C−CH2OH Al2O3, H2SO4→ H2C=CH2 + H2O
Reakcja halogenoetanu z silną zasadą:
H3C−CH2X + MeOH T→ H2C=CH2 + MeX + H2O
np. H3C−CH2Br + KOH T→ H2C=CH2 + KBr + H2O
Reakcja 1,2-dihalogenoetanu z pyłem cynkowym
XH2C−CH2X + Zn → H2C=CH2 + ZnX2
Można także postępować odwrotnie otrzymując eten z etynu w
procesie hydrogenacji (uwodornienia):
HC≡CH + H2 → H2C=CH2
Na skalę przemysłową eten otrzymuje się z gazu ziemnego i ropy naftowej.
Reakcje, którym ulegają alkeny i ich pochodne zostaną przedstawione w kolejnych rozdziałach.
Dieny
Wykraczając nieco poza program warto wspomnieć, że istnieją związki posiadające więcej, niż jedno wiązanie podwójne (jest to zjawisko bardzo częste). Związki, które posiadają dwa wiązania podwójne to dieny i ich pochodne.
Dieny dzieli się na trzy grupy w zależności od tego jak bardzo oddalone są od siebie wiązania podwójne. Wyróżniamy dieny skumulowane (tzw. alleny), sprzężone oraz izolowane.
Alleny
Dieny skumulowane to związki organiczne posiadające w cząsteczce charakterystyczne ugrupowanie:
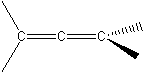
Niektóre alleny są chiralne (→ izomeria optyczna). Nie jest to jednak chiralność tetraedryczna, a osiowa. Wyróżniamy tu oś chiralności. Podobną oś można znaleźć u związków jak ten:
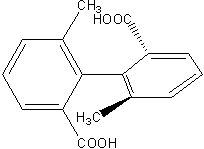
Ryc. 12. Kwas 6,6'-dimetylobifenylo-2,2'-dikarboksylowy wykazuje chiralność osiową
Powracając do allenów. Przykładowym związkiem może być 1-bromo-1-chloro-3-fluoro-3-jodopropa-1,2-dien występuje on w dwóch postaciach izomerycznych. Konfigurację osi chiralności można opisywać za pomocą dwóch systemów.
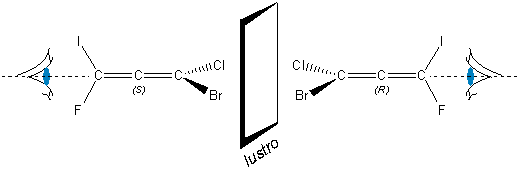
Którykolwiek sposób wybierzemy trzeba na początek wykonać projekcję Newmana danego związku. Dla tych rozrysowanych poprzednio już zaznaczyłem, z której strony spojrzymy na każdy (choć wynik nie byłby inny gdybyśmy spojrzeli z drugiej strony).
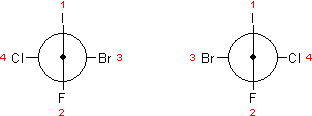
Następnie numerujemy atomy tak, że z dwóch atomów (grup) na pierwszym planie wybieramy ten o wyższym pierwszeństwie w systemie Cahna-Ingolda-Preloga (→ izomeria optyczna) i przypisujemy mu (jej) numer 1. Drugi podstawnik na pierwszym planie zyskuje numer 2. Numer 3 otrzymuje podstawnik z tyłu ważniejszy w systemie CIP, w końcu 4 przypisujemy pozostałemu podstawnikowi.
Ostatni krok to dokonanie spostrzeżenia, w którą stronę "kręcą podstawniki". Gdy narysujemy strzałkę od 1 do 2 (poprzez 4) i od 2 do 3, to jeśli strzałki "kręcą w lewo" - jest to izomer Sa. W przeciwnym wypadku - izomer Ra. Z pomocą tu przychodzi dłoń. Kciuk wbijamy w ekran i sprawdzamy, czy palce lewej, czy prawej ręki wskazują grot strzałki.
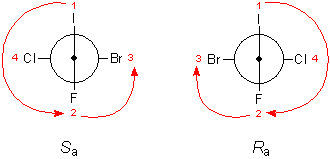
Sa, S od łc. sinister 'lewy', a jak ang. axis 'oś'. Analogicznie dla Ra. Istnieje jednak mniej zalecane oznaczenie (P /M). Jego wyznaczanie ilustruje Ryc. 16.
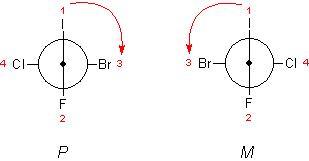
Ryc. 16. System konfiguracji P /M
Alleny są związkami bardzo nietrwałymi ze względu na bliskie sąsiedztwo dwóch wiązań π. Jeśli chodzi o ich reakcje, to reagują podobnie do alkinów. Na dodatek jeśli pozstawić np. propa-1,2-dien to ulegnie on przekształceniu tautomerycznemu (→ tautomeria) w analogiczny alkin w myśl reakcji: H2C=C=CH2 → H3C−C≡CH.
Dieny sprzężone
Sytuacja umiejscowienia wiązań podwójnych może być też taka, że są one oddzielone jednym wiązaniem pojedynczym. Mówimy wtedy, że są to wiązania sprzężone.
O efektach sprzężenia za chwilę. Natomiast teraz o izomerii dienów sprzężonych. Szkielet dienów przy ugrupowaniu C=CH−CH=C może przyjmować dwa kształty. Zilustruję to na przykładzie buta-1,3-dienu. Nie ma tu mowy o izomerii trans-cis, ponieważ przy wiązaniach podwójnych z jednej strony znajdują się dwa atomy wodoru. Natomiast izomeria pomimo to występuje:

Przypomina ona do złudzenia izomerię trans-cis, dlatego nazewnictwo jest analogiczne. S-cis używamy, kiedy wiązania podwójne znajdują się w pozycji synperiplanarnej, zaś s-trans, kiedy są ustawione antyperiplanarnie (→ kąt torsyjny).
Na skutek występowania sprzężenia, a dokładniej efektu indukcyjnego reaktywność dienów sprzężonych jest wyższa od alkenów. Nie jest jednak tak duża jak reaktywność allenów.
Dieny izolowane
O nich jest nie wiele do powiedzenia, choć stanowią chyba najliczniejszą grupę dienów. W cząsteczkach dienów izolowanych wiązania podwójne oddzielone są znaczną ilością wiązań pojedynczych, co powoduje, że nie oddziałują one ze sobą. Dzięki temu właściwości dienów izolowanych są analogiczne do właściwości zwykłych alkenów. Również takie izolowane wiązania nie wywołują żadnej niespotykanej geometrii cząsteczki (zwykła izomeria trans-cis).
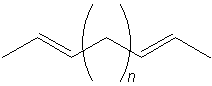
Ryc. 18. Dieny izolowane (np. (2E,5E)-hepta-2,5-dien)
Cyklodieny
Mogą także istnieć związki cykliczne, które posiadają dwa wiązania podwójne. Przykładami takowych mogą być:
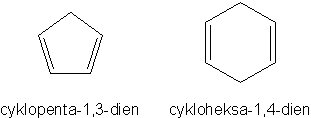
Są to związki o różnorakich właściwościach, nierzadko jednak przypominają one właściwości związków aromatycznych. Warto też wspomnieć o takim dziwolągu nazywanym benzenem Dewara*:
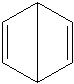
*) Dawniej, gdy nieznano struktury benzenu jedną z propozycji jego budowy wysunął Dewar. Miał to właśnie być bicyklo[2.2.0]heksa-2,5-dien, który faktycznie jest izomerem benzenu zaproponowanego przez Kekulégo.
Polieny
Polieny to związki będące węglowodorami i ich pochodnymi zawierające dwa lub więcej wiązań podwójnych.
Wynika z tego, że do polienów zaliczamy wszystkie rodzaje dienów. Do polienów zaliczają się w szczególności alleny, ponieważ do allenów można zaliczyć związki posiadające więcej ugrupowań >C=C=C<. Ale polieny to także trieny i bardziej nienasycone związki. Tu z kolei należy wspomnieć o cyklopolienach sprzężonych, czyli o związkach aromatycznych.
Areny, bo tak zwykło się nazywać związki aromatyczne to układy cykliczne posiadające naprzemiennie rozmieszczone wiązania podwójne i pojedyncze. Na skutek rezonansu wiązania podwójne i pojedyncze ulegają degeneracji; tworzy się duży, zdelokalizowany orbital, a elektrony są równomiernie rozmieszczone w centralnej części cząsteczki.
Długości wiązań C−C i C=C są równe, a sama cząsteczka traci jakby charakter nienasycony. Szczegółowo o arenach będziemy mówić w osobnym rozdziale specjalnie im poświęconym.
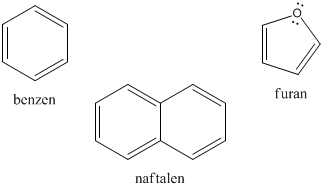
Ryc. 21. Przykładowe związki aromatyczne (wzory Kekulégo)