Halogenoalkany
Już w poprzednim rozdziale poznałeś nazewnictwo chloroalkanów, które zaliczają się do halogenoalkanów. Halogeny to pierwiastki 17 (VII A) grupy układu okresowego, czyli są to fluorowce. Właściwości analogicznych halogenoalkanów są bardzo zbliżone i często nie ma znaczenia dla omawianego problemu jaki fluorowiec znajduje się w cząsteczce. W takiej sytuacji we wzorze pojawia się symbol X - jest to przyjęty symbol międzynarodowy.
X ∈ {F, Cl, Br, I}
Natomiast w nazwie zamiast fluor, chlor, brom, czy jod pojawia się słowo halogen. Zamiast 2,2-dichloropropanu mamy 2,2-dihalogenopropan, a zamiast 1-chloro-2-fluoroetanu możemy mówić o 1,2-dihalogenoetanie. Oczywiście nie zawsze jest to obojętne. Wtedy rozpatrujemy problem na konkretnych nazwach.
To już na pewno wiesz, ale trzeba to powiedzieć dla formalności, że halogenowęglowodory to fluorowcopochodne węglowodorów. Wśród nich wyróżniamy fluorowcoalkany, którymi będziemy się teraz zajmować.
Otrzymywanie
Powiedzieliśmy już, że alkany stosunkowo trudno wchodzą w jakiekolwiek reakcje chemiczne. Wyjątek stanowi reakcja spalania, którą już omówiliśmy oraz reakcja halogenowania. Najczęściej mówi się o chlorowaniu, tak więc rozpatrzmy mechanizm reakcji chlorowania metanu.
Chlorowanie metanu jako reakcja substytucji rodnikowej
Omawiana reakcja zachodzi wg mechanizmu wolnorodnikowego. Na początku działanie światła powoduje rozpad cząsteczki chloru na dwa rodniki.
Cl−Cl hν→ 2 Cl•
Oznaczenie hν mówi, że czynnikiem powodującym rozpad jest fala elektromagnetyczna (światło). Proces ten rozpoczyna szereg reakcji, dla tego nazywany jest inicjacją - rozpoczęciem.
Dalej zachodzą etapy propagacji - rozwinięcia, które powtarzają się cyklicznie tak długo, aż wszystkie rodniki w reaktorze zostaną wyczerpane.
CH4 + Cl• → CH3• + HCl
CH3• + Cl2 → CH3Cl + Cl•
Powstające rodniki chloru mogą atakować dalsze cząsteczki metanu i tak w kółko. Reakcje doprowadzające do wygaszenia procesu to reakcje terminacji - zakończenia.
Cl• + Cl• → Cl2
CH3• + Cl• → CH3Cl
CH3• + CH3• → C2H6
Przedstawiona reakcja jest reakcją rodnikową, ponieważ zachodzi wg mechanizmu wolnorodnikowego. Jest reakcją fotochemiczną, ponieważ w fazie inicjacji wymagany jest dostęp światła. Jest też reakcją łańcuchową, ponieważ procesy propagacji napędzają się wzajemnie powtarzając się cyklicznie. I w końcu jest to reakcja substytucji, czyli podstawienia, bo jeden atom jest wymieniany na inny.
To jednak nie koniec. Kto zabroni rodnikowi chlorowemu zaatakować chlorometan? Mogą więc zachodzić dalsze podstawienia.
CH3Cl + Cl• → CH2Cl• + HCl
CH2Cl• + Cl2 → CH2Cl2 + Cl•
CH2Cl2 + Cl• → CHCl2• + HCl
CHCl2• + Cl2 → CHCl3 + Cl•
CHCl3 + Cl• → CCl3• + HCl
CCl3• + Cl2 → CCl4 + Cl•
Niestechiometrycznie możemy powiedzieć, że z chloru i metanu powstają: CH3Cl, CH2Cl2, CHCl3, CCl4, a także produkty uboczne HCl w tym wyższe węglowodory jak C2H5 oraz ich chloropochodne, oczywiście w śladowych ilościach.
Halogenowanie alkanów
Wolnorodnikowe halogenowanie alkanów zachodzi w analogiczny sposób dla innych fluorowców i innych alkanów. Są jednak pewne różnice. Np. chlorowanie propanu doprowadzi do powstania 1-chloropropanu, 2-chloropropanu jako jednopodstawionych pochodnych obok innych wielopodstawionych.
| Stopień podstawienia | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|---|
| Ilość izomerów | 1 | 2 | 4 | 5 | 6 | 5 | 4 | 2 | 1 |
Jak widać powstaje 29 chloropochodnych propanu, a do tego należałoby doliczyć śladowe ilości heksanu i jego pochodnych. Należałoby zastanowić się jakie będą relacje pomiędzy ilościami powstających związków.
Stopień podstawienia będzie ściśle zależny od warunków przeprowadzania reakcji. Jednak rozpatrując np. jednopochodne halogenowanego alkanu widać, że relacje ilości powstających izomerów są w miarę stałe. Dla uproszczenia rozpatrzmy sytuację tylko dla jednopochodnych.
Doświadczalnie zmierzono reaktywność atomów wodoru:
| I° | II° | III° | |
|---|---|---|---|
| Chlorowanie | 1 | 3,7 | 5 |
| Bromowanie | 1 | 80 | 1600 |
Reaktywność atomów wodoru o różnej rzędowości w reakcji substytucji chlorem i bromem
Widać z powyższego, że atomy wodoru III° są najbardziej reaktywne, II° mniej, a I° są znacznie mniej reaktywne. Widać też, że produkty bromowania nie są tak różnorodne jak produkty chlorowania. Mówimy, że brom działa bardziej selektywnie.
Wiemy już, że zachodzą reakcje:
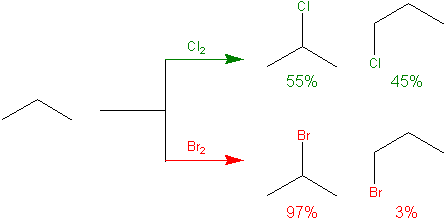
W jaki sposób wyznaczyć ilość powstających produktów?
Obliczmy względną reaktywność atomów pierwszorzędowych jako iloczyn reaktywności i ilości I° atomów wodoru w cząsteczce propanu. Dla chlorowania będzie to:
rI° = 6 ⋅ 1 = 6
rII° = 2 ⋅ 3,7 = 7,4
Procenty zawartości produktu I° i II° w sumie mają dać 100% (patrzymy tylko na izomery jednopodstawione, można założyć inaczej).
pI° + pII° = 100%
pI° / pII° = rI° / rII° = 6 / 7,4
pI° = 44,776%
pII° = 55,224%
Analogicznie dla bromowania:
rI° = 6 ⋅ 1 = 6
rII° = 2 ⋅ 80 = 160
pI° + pII° = 100%
pI° / pII° = rI° / rII° = 6 / 160
pI° = 3,6%
pII° = 96,4%
Inne sposoby
Istnieją jeszcze inne metody otrzymywania halogenoalkanów. Jednym z nich jest addycja, którą poznasz bliżej przy omawianiu węglowodorów nienasyconych. W konkretnych źródłach można odszukać specyficzne reakcje, w których powstają żądane fluorowcopochodne związków organicznych.
Otrzymywanie halogenków (halogenki alkilu = halogenowęglowodory) z alkoholi zostanie omówione przy alkoholach.
Freony
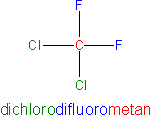
Freony to związki, w których wszystkie atomy wodoru zostały zastąpione atomami chloru i fluoru.
CnFxCl2n+2-x
Przy czym x ∈ ⟨1; 2n+1⟩.
Freony nie są związkami ciekawymi z chemicznego punktu widzenia, gdyż są bierne chemicznie. Z tego powodu, jak również dlatego, że są nietoksyczne, wykorzystywano je w aerozolach i lodówkach. Z czasem okazało się, że freony wywierają zgubny wpływ na atmosferyczną warstwę ozonu.

Ozon jest alotropową odmianą tlenu znajdującą się w atmosferze, która chroni nas przed nadmiarem promieniowania ultrafioletowego UV (ang. ultra violet) pochodzącego ze słońca.
Freony są katalizatorami reakcji: 2 O3 freony→ 3 O2, która prowadzi do zaniku warstwy ozonowej. Skutkiem tego jest zjawisko nazywane dziurą ozonową.
Obecnie produkcja i emisja freonów została znacząco ograniczona, co ma doprowadzić w przyszłości do regeneracji warstwy ozonu w Naszej atmosferze. Produkty uwolnione od freonów posiadają znak ozone-friendly, ozon freundlich, ohne FCKW, czy też CFC free.