Cząsteczki
Wiemy, że atomy łączą się ze sobą w celu pozbywania się nadmiaru energii, który znajduję się w atomach w stanie wolnym. Dokonują tego uzyskując idealną konfigurację gazów szlachetnych osiągając symetrycznie wypełnione orbitale. Układy o dużej symetrii są niżej energetyczne od tych asymetrycznych. To powoduje, że nie tylko elektrony w atomach, ale nawet same atomy w cząsteczkach są rozmieszczone symetrycznie. O tym będzie mowa w w dalszej części rozdziału poświęconej VSEPR.
Połączone ze sobą atomy nazywamy cząsteczką. Same połączenia nazywamy zaś wiązaniami. Wyróżniamy kilka rodzajów wiązań, które zostaną szczegółowo omówione w rozdziale Wiązania chemiczne. Dwoma najpopularniejszymi typami są wiązania kowalencyjne i jonowe pomimo tego, że najczęściej chyba występującym wiązaniem jest wiązanie pomiędzy nimi pośrednie - kowalencyjne spolaryzowane.
Ponieważ człowiek ma tendencję do upraszczania wszystkiego jak tylko się da, więc często nawet wiązania "czysto" jonowe traktuje się jako kowalencyjne zapominając na chwilę o rzeczywistej budowie cząsteczki. Nie trudno Ci chyba gdziekolwiek odnaleźć wzór tego typu:

W rzeczywistości jest on bardzo niepoprawny, jeśli interesują nas typy wiązań. Jeśli zaś chodzi o skład tego związku to może być, ale lepiej już byłoby opisać wzorem Al2nS3n, ponieważ w rzeczywistości takie cząsteczki nigdy nie występują. W stanie stałym tworzona jest sieć krystaliczna składająca się z wielu atomów. W takiej sytuacji cały (nawet duży) kryształ można uznać za jedną cząsteczkę. Wzór Al2nS3n wskazuje tylko proporcje między poszczególnymi składnikami kryształu.
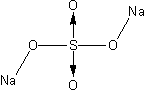
Podobna sytuacja odnosi się do przedstawionego wyżej związku o prawidłowym wzorze Na2n(SO4)n. Jego wzór strukturalny można rozrysować następująco:
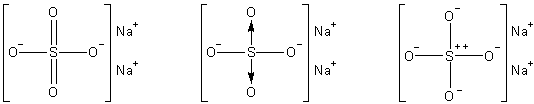
Cząsteczki są elementami, które tworzą związki chemiczne tak jak atomy tworzą pierwiastki. Tym samym związek chemiczny będziemy mogli zdefiniować analogicznie jak pierwiastek.
Związek chemiczny to zbiór wszystkich cząsteczek o jednakowej masie, składzie i ułożeniu atomów w cząsteczce.
Kształt cząsteczek
Istnieje wiele metod, które pozwalają na przewidywanie kształtu cząsteczek. Jedną z takich metod jest VSEPR, która znajduje zastosowanie przy poszukiwaniu kształtu niewielkich, zwykle nieorganicznych cząsteczek. Przy bardziej złożonych strukturach niestety zawodzi.
Bardziej ogólną od VSEPR jest metoda orbitali molekularnych liniowej kombinacji orbitali atomowych (LCAO-MO), która jest jednak o wiele trudniejsza do zastosowania (omówiona zostanie w tomie Chemia kwantowa).
Cząsteczki dążą do uzyskania jak największej symetrii. Nie tylko atomy, ale także często niezauważane wolne pary elektronowe należy brać pod uwagę przy opisie symetrii. Oto przykłady najprostszych symetrii:
Przykładem liniowej cząsteczki (kąty 180°) jest ditlenek węgla(IV):
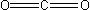
Trójkątem płaskim (kąty 120°) jest bromek glinu:
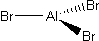
Zaś tetraedryczne cząsteczki (kąty 109°28′) to np. metan, czy woda.
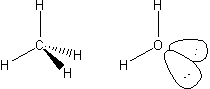
Właśnie w wodzie często nie dostrzegamy wolnych par elektronowych tlenu, a to one powodują, że cząsteczka nie jest liniowa, tylko kątowa.
VSEPR
VSEPR, czyli ang. Valence Shell Electron Pair Repulsion 'koncepcja odpychania par elektronowych powłoki walencyjnej'. Została opracowana w 1940 roku przez N.V. Sidgwicka i H.M. Powella. Jest przydatna dla pierwiastków grup reprezentatywnych (bloki s i p). By się nią posługiwać należy wyróżnić atom centralny i ligandy (podstawniki). Jeśli nie jest to możliwe - teoria VSEPR nie jest przydatna i pozostaje dość ogólna metoda LCAO-MO.
Dużo o VSEPR w języku angielskim znajdziesz na www.chem.purdue.edu/~.
Metoda wyznaczania kształtu cząsteczek
- Narysuj wzór Lewisa dla cząsteczki lub jonu XRmEn - R to podstawniki, a E to wolne pary elektronowe.
- Policz ile jest wszystkich regionów wysokiej gęstości
elektronowej (δ = m + n) wokół atomu
centralnego. W ten sposób wyznaczasz tzw. Liczbę
przestrzenną.
- Podwójne i potrójne wiązania licz jako jeden region wysokiej gęstości elektronowej.
- Niesparowane elektrony licz jako jeden region wysokiej gęstości elektronowej.
- Dla cząsteczek lub jonów, które mają struktury rezonansowe możesz użyć dowolnej z nich.
- Zgodnie z liczbą przestrzenną i ilością wolnych par elektronowych dobierz odpowiedni kształt cząsteczki (→ tabela).
- Rozmieść odpowiednio ligandy i wolne pary elektronowe wokół atomu. Możesz to zrobić w miarę dowolnie, ale pamiętaj, aby wolne pary elektronowe były w miejscach oznaczonych szarymi liniami.
- Kształt cząsteczki wyznaczają atomy, a nie regiony wysokiej gęstości elektronowej.
| Liczba przestrzenna | Brak wolnych par elektronowych (n = 0) | Jedna wolna para elektronowa (n = 1) | Dwie wolne pary elektronowe (n = 2) | Trzy wolne pary elektronowe (n = 3) |
|---|---|---|---|---|
| δ = 1 | 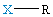 XR, liniowa |
— | — | — |
| δ = 2 sp | 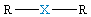 XR2, liniowa |
— | — | — |
| δ = 3 sp2 | 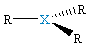 XR3, trójkąt płaski |
 XR2E, kątowa |
— | — |
| δ = 4 sp3 | 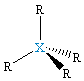 XR4, tetraedr |
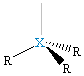 XR3E, piramida trygonalna |
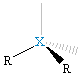 XR2E2, zgięta |
— |
| δ = 5 dsp3 | 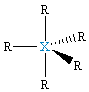 XR5, bipiramida trygonalna |
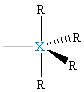 XR4E, pryzmat, huśtawka |
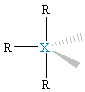 XR3E2, T-kształtna |
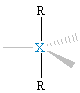 XR2E3, liniowa |
| δ = 6 d 2sp3 | 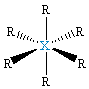 XR6, oktaedr, bipiramida tetragonalna |
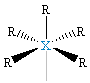 XR5E, piramida tetragonalna |
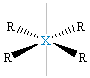 XR4E2, kwadrat płaski |
— |
| δ = 7 d 3sp3 | 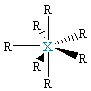 XR7, bipiramida pentagonalna |
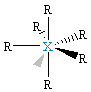 XR6E, zdeformowany oktaedr |
— | — |
Tab. Liczba przestrzenna, a kształt cząsteczki: X - atom centralny, R - ligandy, szare linie - wolne pary elektronowe.
Przykłady
- XR
- F2
- HCl
- H2
- XR2
- HCN
- HNC
- CO2
- BeCl2
- XR3
- BF3
- AlCl3
- Cl2CO → O=C(Cl)Cl
- C2H4*
- HCHO
- CO32−
- NO3−
- XR2E
- SO2
- O3
- NO2−
- XR4
- CH4
- ClO4−
- PH4+
- PO43−
- SO42−
- XR3E
- NH3
- SO32−
- XR2E2
- H2O
- ClO2−
- XR5
- PBr5
- SOF4
- PCl5
- XR4E
- SF4
- TeCl4
- XR3E2
- ClF3
- ICl3
- XR2E3
- I3−
- BrICl−
- XeF2
- XR6
- TeO66−
- PF6−
- SeF6
- SF6
- XR5E
- BrF5
- SbF52−
- ClF5
- XR4E2
- XeF4
- ICl4−
- XR7
- IF7
- ClF7
- XR6E
- XeF6